Выдать под отчет | СБИС Помощь
Выдать под отчетВ СБИС подотчетные средства можно выдать только сотруднику, который добавлен в систему.
Если вы индивидуальный предприниматель — ваша карточка автоматически создается в СБИС в разделе «Сотрудники» после регистрации. Поэтому вы можете указать себя в качестве подотчетного лица при оформлении документов.
Деньги подотчетному лицу можно выдать наличными из кассы или перевести с расчетного счета организации на банковскую карту. Если в системе уже создан авасновый отчет, оформите выдачу средств из него: получатель и сумма платежа определятся автоматически.
Выдать наличными
Перевести на банковскую карту
Посмотреть проводки
Подотчетные суммы в СБИС можно выдать одному или сразу нескольким сотрудникам. Для этого оформите:
- «Выдачу подотчетных сумм» — если требуется выдать деньги одному сотруднику;
- «Выдачу подотчетных сумм по ведомости» — если требуется выдать деньги нескольким сотрудникам.

Выдать деньги под отчет одному сотруднику
- В разделе «Деньги/Касса» нажмите Расход и выберите «Выплаты сотрудникам/Выдача подотчетных сумм».
- Укажите кассу организации.
- В поле «Кому» выберите сотрудника, которому выдаете денежные средства.
- Введите сумму выплаты.
- Сохраните и распечатайте документы для заполнения. Для этого кликните , выберите документы и нажмите «Распечатать».
- Нажмите Провести. СБИС сформирует проводки по операции.
Кроме расходного ордера в СБИС можно распечатать заявление на выдачу под отчет.
Выдать деньги под отчет нескольким сотрудникам
- В разделе «Деньги/Касса» нажмите Расход и выберите «Выплаты сотрудникам/Выдача подотчетных сумм по ведомости».
- Укажите кассу организации.
- В поле «Кому» выберите кассира, который будет выдавать денежные средства.
- Добавьте сотрудников кнопкой и введите подотчетные суммы. Общая сумма рассчитается автоматически.
- Нажмите Провести. СБИС сформирует проводки по операции.
Также вы можете добавить сотрудников кнопкой «заполнить» — СБИС автоматически подберет сотрудников, у которых есть перерасход по авансовым отчетам. Он отражается по Кт 71 счета.
Он отражается по Кт 71 счета.
После использования подотчетных средств оформите в СБИС авансовый отчет.
Оформить из авансового отчета
Вы можете оформить выдачу денег под отчет из авансового отчета. Например, если сотрудник потратил собственные средства и оформил отчет в СБИС.
- Откройте авансовый отчет, по которому формируете выплату.
- Нажмите и выберите:
- «Расходный кассовый ордер/Выплаты сотрудникам/Выдача подотчетных сумм», чтобы оформить выдачу наличных одному сотруднику;
- «Расходный кассовый ордер/Выплаты сотрудникам/Выдача подотчетных сумм по ведомости», чтобы оформить выдачу наличных нескольким сотрудникам.
- Проведите платеж.
СБИС заполнит документ данными из авансового отчета.
Подотчетные суммы в СБИС можно перечислить на банковскую карту одному или нескольким сотрудникам. В зависимости от того, как требуется выполнить перевод денег, оформите:
- «Выдачу подотчетных сумм» — если будете переводить на лицевой счет сотрудника;
- «Выдачу подотчетных сумм на карту сотрудника» — если переводите сотруднику на карту банка;
- «Выдачу подотчетных сумм по ведомости» — если перечисляете деньги нескольким сотрудникам.

Перевести деньги под отчет сотруднику на лицевой счет
- В разделе «Деньги/Банк» нажмите Расход и выберите «Выплаты сотрудникам/Выдача подотчетных сумм».
- Выберите расчетный счет списания.
- Укажите сотрудника, которому нужно перевести денежные средства, и его лицевой счет.
- Введите сумму выплаты.
- Нажмите «Сохранить» и выгрузите платеж в клиент-банк.
Если требуется, заполните код дохода. Например, укажите код «2», если это командировочные расходы.
После загрузки выписки платеж может быть проведен автоматически или вручную, в зависимости от настройки системы.
Перевести деньги под отчет сотруднику на карту банка
- В разделе «Деньги/Банк» нажмите Расход и выберите «Выплаты сотрудникам/Выдача подотчетных сумм на карту сотрудника».
- Выберите расчетный счет списания.
- Укажите банк, к которому привязана карта сотрудника, и расчетный счет банка.
- В поле «За кого» добавьте сотрудника — держателя карты.

- Введите сумму выплаты.
- В назначении платежа добавьте номер карты сотрудника.
- Нажмите «Сохранить» и выгрузите платеж в клиент-банк.
Если требуется, заполните код дохода. Например, укажите код «2», если это командировочные расходы.
После загрузки выписки платеж может быть проведен автоматически или вручную, в зависимости от настройки системы.
Перевести деньги под отчет нескольким сотрудникам
Если у организации заключен с банком договор зарплатного проекта, можно перечислять подотчетные суммы сразу нескольким сотрудникам.
- В разделе «Деньги/Банк» нажмите Расход и выберите «Выплаты сотрудникам/Выдача подотчетных сумм по ведомости».
- Выберите расчетный счет списания денег.
- Укажите банк и расчетный счет зарплатного проекта.
- Добавьте сотрудников кнопкой и введите подотчетные суммы. Общая сумма выплаты рассчитается автоматически.
- Сохраните документ и сформируйте электронный реестр кнопкой .
- Выгрузите платеж в клиент-банк.
Если требуется, заполните код дохода. Например, укажите код «2», если это командировочные расходы.
После загрузки выписки платеж может быть проведен автоматически или вручную, в зависимости от настройки системы.
Обратите внимание, документ выплаты можно оформить не раньше даты создания карточки сотрудника.
После использования подотчетных денежных средств создайте в СБИС авансовый отчет.
Оформить из авансового отчета
Вы можете оформить перевод денег под отчет. Например, если сотрудник потратил собственные средства и оформил авансовый отчет в СБИС.
- Откройте авансовый отчет, по которому формируете выплату.
- Нажмите и выберите:
- «Исходящий платеж/Выплаты сотрудникам/Выдача подотчетных сумм», чтобы оформить перевод сотрудникуна лицевой счет;
- «Исходящий платеж/Выплаты сотрудникам/Выдача подотчетных сумм на карту сотрудника», чтобы оформить перевод сотруднику на карту банка;
- «Исходящий платеж/Выплаты сотрудникам/Выдача подотчетных сумм по ведомости», чтобы ооформить перевод нескольким сотрудникам.

- Проведите платеж.
СБИС заполнит документ данными из авансового отчета.
СБИС сформирует по выплатам бухгалтерские проводки. Нажмите , чтобы их посмотреть.
Выдача подотчетных сумм наличными
Перевод подотчетных сумм на банковскую карту
В аналитике по 71 счету указаны фамилии сотрудников, которым выдана подотчетная сумма.
Лицензия
Любой тариф сервиса «Бухгалтерия и учет». Приобретается вместе с тарифами сервиса «Отчетность через интернет».
Нашли неточность? Выделите текст с ошибкой и нажмите ctrl + enter.
Бланк заявление о выдачеперечислении денежных средств под отчет
Заявление необходимо как основание для выдачи денег в подотчет из кассы. Подотчетником может быть любое лицо, работающее у вас по трудовому или гражданско-правовому договору. Заявление на деньги подотчет составляется от имени подотчетника и визируется директором либо иным лицом, которому директор по доверенности дал полномочия принимать решения о расходовании денег из кассы. Если деньги нужно выдать под отчет самому директору уполномоченному им лицу , то вместо заявления оформляется распоряжение. Все поля, включая даты и суммы, при желании можно заполнить на компьютере до распечатки заявления.
Если деньги нужно выдать под отчет самому директору уполномоченному им лицу , то вместо заявления оформляется распоряжение. Все поля, включая даты и суммы, при желании можно заполнить на компьютере до распечатки заявления.
Если вы хотите узнать, как решить именно Вашу проблему — обращайтесь в форму онлайн-консультанта справа или звоните по телефонам, представленным на сайте. Это быстро и бесплатно!
Заявление на выдачу наличных под отчет
Нужно выдать деньги под отчет сотруднику или директору? На каком бланке им писать заявление о о выдаче денег под отчет? Как выглядит образец такого заявление? Приведем пример заявления о выдаче денег в подотчет.
Если вы хотите узнать, как решить именно Вашу проблему — обращайтесь по ссылке ниже. Это быстро и бесплатно! Зачастую хозяйствующие субъекты осуществляют свои текущие расходы через подотчетных лиц. Ими, как правило, являются работники организаций ИП , которые пишут заявление на выдачу денег под отчет , получают N-ую сумму, тратят ее на конкретные цели:.
Порядок выдачи подотчетных сумм в наличной форме регламентируется Указаниями Банка России от Разберем, какие именно правила подотчета устанавливает данный документ.
Это следует из п. Но это не только те физлица, с которыми компания состоит в трудовых отношениях. Согласно п. Например, организация вправе выдать денежные средства под отчет подрядчику на покупку материалов, необходимых для выполнения работ по договору ГПХ письмо ЦБ РФ от Денежные средства под отчет можно выдать не только наличными из кассы предприятия, но и перечислить на банковскую карту зарплатную или корпоративную.
Это подтверждают письма: Минфина России от При этом порядок безналичных расчетов по подотчетным суммам должен быть прописан в локальном нормативном акте компании например, в учетной политике или положении о расчетах с подотчетными лицами. Закон не устанавливает каких-либо ограничений по сроку, на который выдаются деньги подотчетному лицу.
Поэтому его продолжительность может быть любая, хоть год. По желанию руководитель может самостоятельно ввести соответствующие ограничения, закрепив это приказом. Абзац 3 п. За нарушение данного запрета некоторые налоговики даже могут оштрафовать по ст.
Хотя такая мера наказания может быть оспорена в суде, поскольку ст. Но не факт, что решение будет в Вашу пользу Постановление Девятого арбитражного апелляционного суда от Если компания не готова к судебным тяжбам, то лучше соблюдать последовательность: сначала работник гасит долг по старому подотчету или компания возмещает ему перерасход , а уже потом он получает новую сумму. Без письменного заявления от работника выдать деньги под отчет нельзя.
На это указывает абз. Документ составляется в произвольной форме. При это в нем обязательно указываются:. Обратите внимание! В соответствии с новым кассовым порядком п. До 1 июня года заполнять эти реквизиты собственноручно приходилось руководителю п.
Теперь же достаточно только его визы. При составлении заявления на выдачу денег под отчет работники нередко допускают ошибки. Например, не указывают срок, на который выдаются денежные средства. Для того, чтобы документ был оформлен правильно и работнику не приходилось каждый раз сочинять его текст, рекомендуется заранее подготовить шаблоны заявления. Кстати, безопаснее написать заявление на выдачу денег под отчет и в том случае, если денежные средства перечисляются на зарплатную карту с расчетного счета.
При его отсутствии налоговики могут посчитать, что работнику были переведены не подотчетные суммы, а иные доходы и удержат с них НДФЛ. Еще раз обратим внимание , что писать такое заявление должны все получатели подотчетных средств, включая руководителя.
Ведь в компании он трудится, как и все, по трудовому договору ч. Одобренное заявление на выдачу денег под отчет передается в бухгалтерию. К сведению ИП, ведущих налоговый учет доходов или доходов и расходов, а также физических показателей.
В соответствии с абз. Предупредите получателя, что ему не следует передавать подотчетные деньги другому лицу. Хотя законодательством не установлен запрет на подобные действие, но, в то же время, не регламентирован и порядок передачи. Поэтому, чтобы избежать споров с налоговиками, не разрешайте сотрудникам передавать подотчетные суммы своим коллегам.
В течение 3-х рабочих дней по истечении срока, на который были выданы деньги под отчет указывается в заявлении , работник должен отчитаться о своих тратах абз. Для этих целей он использует авансовый отчет. В соответствии с ч. Постановлением Госкомстата РФ от К авансовому отчету работник прилагает все подтверждающие документы.
Если окажется, что он потратил больше, чем получил, то организация ИП обязана ему возместить сумму перерасхода. Постановлением Госкомстата России от Полное или частичное копирование материалов запрещено.
Постановлением Госкомстата России от Полное или частичное копирование материалов запрещено.
Заявление на выдачу денег под отчет. Ими, как правило, являются работники организаций ИП , которые пишут заявление на выдачу денег под отчет , получают N-ую сумму, тратят ее на конкретные цели: на покупку товарно-материальных ценностей например, канцтоваров ; на оплату услуг, работ; на командировочные расходы; на отправку корреспонденции и пр. Как можно выдать деньги под отчет Денежные средства под отчет можно выдать не только наличными из кассы предприятия, но и перечислить на банковскую карту зарплатную или корпоративную.
На какой срок можно выдать деньги под отчет Закон не устанавливает каких-либо ограничений по сроку, на который выдаются деньги подотчетному лицу. Проверьте задолженность по подотчетным суммам Абзац 3 п. Основание для выдачи денег под отчет Без письменного заявления от работника выдать деньги под отчет нельзя.
При это в нем обязательно указываются: необходимая сумма; срок, на который выдаются средства; подпись руководителя; дата написания заявления. Скачать бланк заявления на выдачу денег под отчет из кассы в формате Excel Скачать бланк заявления на выдачу денег под отчет на карту в формате Excel Скачать бланк заявления на выдачу денег под отчет из кассы директору в формате Excel. Скачать бланк заявления на выдачу денег под отчет из кассы в формате Word Скачать бланк заявления на выдачу денег под отчет на карту в формате Word Скачать бланк заявления на выдачу денег под отчет из кассы директору в формате Word Скачать образец заявления на выдачу денег под отчет из кассы в формате Word Скачать образец заявления на выдачу денег под отчет на карту в формате Word Скачать образец заявления на выдачу денег под отчет из кассы директору в формате Word.
Скачать бланк заявления на выдачу денег под отчет из кассы в формате Excel Скачать бланк заявления на выдачу денег под отчет на карту в формате Excel Скачать бланк заявления на выдачу денег под отчет из кассы директору в формате Excel. Скачать бланк заявления на выдачу денег под отчет из кассы в формате Word Скачать бланк заявления на выдачу денег под отчет на карту в формате Word Скачать бланк заявления на выдачу денег под отчет из кассы директору в формате Word Скачать образец заявления на выдачу денег под отчет из кассы в формате Word Скачать образец заявления на выдачу денег под отчет на карту в формате Word Скачать образец заявления на выдачу денег под отчет из кассы директору в формате Word.
Недавние изменения в законодательстве несколько упростили работу бухгалтеров с подотчетными средствами. Мы разобрались, в чем заключаются преимущества. Читайте, какой порядок выдачи подотчетных сумм действует в году. Например, приобрести хозяйственные или канцелярские товары. Такие денежные средства называются подотчетными, а работник, который их получил, является подотчетным лицом.
Их перечень определяется приказом по предприятию, который утверждается руководителем организации. В приказе должно быть четко перечислены те лица, которые могут брать деньги в подотчет, при необходимости прописываются размеры предельных сумм. Текущая версия Вашего браузера не поддерживается. Путеводитель по кадровым вопросам. Служебные командировки Вправе ли работодатель перечислить работнику подотчетные суммы командировочных расходов на зарплатную банковскую карту?
Выдача наличных денег работнику под отчет производится на расходы, связанные с осуществлением деятельности юридического лица, индивидуального предпринимателя. Это могут быть расходы на покупку канцтоваров, на изготовление визиток, рекламы или информационных услуг и другие разумные расходы организации.
Заявление на подотчет — образец годов можно скачать в этой статье. В процедуру составления такого заявления внесен ряд изменений, ознакомиться с которыми вы можете в материале ниже. Изменения в заявлении на подотчет в году.
В процедуру составления такого заявления внесен ряд изменений, ознакомиться с которыми вы можете в материале ниже. Изменения в заявлении на подотчет в году.
Как выглядит заявление подотчетного лица о выдаче денег. Образец заявления на получение денег в подотчет. В экономическом обороте расчеты регламентированы специальными нормативными актами. Подробнее об этом читайте в нашей статье по ссылке: Законодательство о наличной и безналичной формах расчетов. Сделки в интересах организации могут совершать ее сотрудники за счет выданных им средств. Ниже в статье размещена ссылка на образец заявления о выдаче денежных средств в подотчет.
Работа с наличными деньгами и кассовые операции строго регламентированы в целях контроля за оборотом. Перечисление под отчет денег на карточку работника намного удобнее по сравнению с наличными расчетами: не нужно оформлять кассовые документы, ездить в банк для снятия наличных денежных средств. Однако, как показывает практика, эти удобства перечеркиваются списанием поступивших денег в уплату долгов работника например, кредитов , блокировкой карточки работника.
Подотчетные деньги компания может перечислить на зарплатную либо личную банковскую карту работника. В перечень подотчетных расходов входят представительские, командировочные расходы, расходы на административно-хозяйственные нужды приобретение канцелярии, хозяйственного инвентаря, обслуживание офисной техники и аналогичные расходы. Основанием для выплаты подотчетной суммы является приказ распоряжение, решение , подписанное руководителем компании. Необходимости оформлять работнику заявление на выдачу денежных средств под отчет нет.
При этом выдача перечисление на банковскую карту подотчетных сумм может осуществляться и при наличии задолженности у подотчетного лица. В работе с подотчетными много нюансов. Смотрите порядок выдачи денег подотчет и образцы заявлений. В августе года Центробанк внес изменения в правила выдачи денежных средств из кассы. В чем суть этих нововведений и как теперь работать с подотчетниками, вы узнаете из нашей статьи. Как производится выдача денежных средств в подотчет?
По какой форме подавать заявку на выдачу денежных средств? По какой форме издавать приказ о выдаче денег? В какие сроки нужно уложиться? Правила составления заявления на выдачу денег под отчет в прошлом году упростились.
Заявление на выдачу денег в подотчет 2019 бланк
Заявление на подотчет от директора — образец его вы увидите в этой публикации — законодательно не регламентирован. Кроме того, существует ряд разногласий на тему, стоит ли его вообще оформлять. Подробнее эти вопросы разберем в данной статье. Особенности выдачи средств под отчет директору. Как оформляется заявление о выдаче денег под отчет директору.
Порядок осуществления расчетов с подотчетными лицами целесообразно определить в локальном нормативном акте организации или ИП. Данный документ определяет круг подотчетных лиц, цели и сроки выдачи денег. А также сократит ряд вопросов со стороны подотчетных лиц, кассиров и контролирующих органов.
В августе года Центробанк обновил правила выдачи денежных средств из кассы. А с 1 июля года выдача денег под отчет сотрудникам организации осуществляется с учетом еще нескольких изменений. В чем суть этих нововведений, и как теперь работать с подотчетниками? Указание ЦБ РФ от Суть нововведений года заключается в следующем:.
В чем суть этих нововведений, и как теперь работать с подотчетниками? Указание ЦБ РФ от Суть нововведений года заключается в следующем:.
Бланк заявление о выдачеперечислении денежных средств под отчет
Шаблоны и формы Разбираемся с новыми правилами для подотчета С августа года начали действовать новые правила на выдачу денег сотрудникам. Кто теперь имеет право получить подотчетные средства и как их выдавать в году, расскажем в статье. Задорожнева Александра Какие изменения нужно учитывать в году Законодательное реформирование положений бухгалтерского учета касательно выдачи денежных средств подотчет в бюджетных учреждениях началось еще в году. Согласно приказу Минфина от Таким образом, в регистрах бюджетного учета обновились аналитические счета, отражающие движение подотчетных сумм. Дорогие читатели! Наши статьи рассказывают о типовых способах решения юридических вопросов, но каждый случай носит уникальный характер. Если вы хотите узнать, как решить именно Вашу проблему — обращайтесь в форму онлайн-консультанта справа или звоните по телефонам, представленным на сайте. Это быстро и бесплатно! Новый бланк авансового отчета Как перевести деньги с расчетного счета в подотчет на карту сотрудника Перечислять деньги под отчет на карту намного проще, чем выдавать наличные.
Если вы хотите узнать, как решить именно Вашу проблему — обращайтесь в форму онлайн-консультанта справа или звоните по телефонам, представленным на сайте. Это быстро и бесплатно! Новый бланк авансового отчета Как перевести деньги с расчетного счета в подотчет на карту сотрудника Перечислять деньги под отчет на карту намного проще, чем выдавать наличные.
Составляем заявление на подотчет — образец на 2019 — 2020 гг.
Формы и образцы бланков кассовых и платежных документов Заявка на получение наличных денег Расшифровка сумм неиспользованных внесенных через банкомат или пункт выдачи наличных денежных средств средств. Заявление на выдачу денег в подотчет в году. Скачать образец: деньги под отчёт директору. На какой срок выдаются подотчётные деньги?
Заявление на подотчет от директора — образец его вы увидите в этой публикации — законодательно не регламентирован. Кроме того, существует ряд разногласий на тему, стоит ли его вообще оформлять.
Кроме того, существует ряд разногласий на тему, стоит ли его вообще оформлять.
Последние изменения в заявлении на подотчет. Как выглядит заявление подотчетного лица о выдаче денег. Образец заявления на получение денег в подотчет.
Выдаем денег в подотчет из кассы
Нужно выдать деньги под отчет сотруднику или директору? На каком бланке им писать заявление о о выдаче денег под отчет? Как выглядит образец такого заявление?
.
Составляем заявление на подотчет от директора — образец
.
Порядок действий при выдаче денежных средств под отчет состоит из следующих этапов: Приказ или заявление на выдачу денег в подотчет
.
Пишем заявление на выдачу подотчетных сумм
.
.
.
.
.
Приказ о выдаче денег в подотчет 2020 года
Как производится выдача денежных средств в подотчет? По какой форме подавать заявку на выдачу денежных средств? По какой форме издавать приказ о выдаче денег? В какие сроки нужно уложиться? Какие изменения в этой части действуют с 2020 года? Давайте разберем актуальный порядок выдачи денежных средств подотчет.
Кому можно выдавать деньги на нужны бизнеса
Работодатели обязаны организовать и вести внутренний контроль совершаемых фактов хозяйственной жизни. Вы можете найти такое требование в части 1 статьи 19 Федерального закона от 06.12.2011 № 402-ФЗ «О бухгалтерском учете». Порядок контроля за выдачей денег подотчетным лицам должен определить генеральный директор компании. Он может издать приказ со списком лиц, которые вправе получать денежные средства. Вот образец такого приказа, по которому может производиться выдача денежных средств под отчет:
Вы можете найти такое требование в части 1 статьи 19 Федерального закона от 06.12.2011 № 402-ФЗ «О бухгалтерском учете». Порядок контроля за выдачей денег подотчетным лицам должен определить генеральный директор компании. Он может издать приказ со списком лиц, которые вправе получать денежные средства. Вот образец такого приказа, по которому может производиться выдача денежных средств под отчет:
В целях соблюдения кассовой дисциплины работником считается человек, с которым заключен трудовой или гражданско-правовой договор (п.п. 5 и 6.3 Указания Банка России от 11.03.2014 № 3210-У). Следовательно, под отчет деньги можно выдать, в том числе, подрядчику. Они могут ему потребоваться, к примеру, для приобретения материалов для выполнения работ по гражданско-правовому договору. Такую сумму под отчет можно выдать ему, например, из кассы.
Подотчетные суммы можно перечислить на банковскую карту подотчетного лица, в т.ч. на зарплатную (Письмо Минфина от 25. 08.2014 № 03-11-11/42288).
08.2014 № 03-11-11/42288).
Заявление о выдаче денег: нужно ли оно?
Еще совсем недавно для получения наличных денежных средств под отчет сотрудник должен был обязательно передать в бухгалтерию или отдел кадров заявку на выдачу денежных средств подотчет. Образец такой заявки показывает, что в ней нужно было указывать необходимую сумму, а также пояснять, на какие цели она будет потрачена. Перед вами образец такого заявления о выдаче денежных средств подотчет:
Однако с 19 августа 2017 года ситуация изменилась. Поправки предусмотрены Указанием Центрального Банка России от 19.06.2017 №4416-У. С указанной даты выдать сотруднику деньги под отчет можно без его заявления. Для выдачи денег достаточно приказа о выдаче денежных средств подотчет или другого распорядительного документа компании. Такие же правила выдаче денег под отчет продолжают действовать в 2020 году.
Как издавать приказ о выдаче денег: пример
Итак, выдача денежных средств в подотчет в 2020 году возможна на основании приказа или другого распорядительного документа (пунктом 6. 3 указаний Банка России от 11 марта 2014 № 3210-У). При этом каких-либо ограничений на размер подотчетных сумм и срок выдачи денег нет. Перед вами приказ о выдаче денежных средств под отчет (образец):
3 указаний Банка России от 11 марта 2014 № 3210-У). При этом каких-либо ограничений на размер подотчетных сумм и срок выдачи денег нет. Перед вами приказ о выдаче денежных средств под отчет (образец):
Более того, нет никаких особый требований к тому, как оформлять приказ на выдачу подотчетных сумм. По нашему мнению, в приказе имеет смысл зафиксировать: Ф. И. О. работника, сумму, цели и сроки выдачи.
Заметим также, что можно издавать общий приказ на несколько сумм. Так, например, если выдача наличных денежных средств в подотчет необходима нескольким сотрудникам, то приказ может выглядеть так:
С 19 августа 2017 года основание для выдачи денежных средств подотчет – это приказ или иной распорядительный документ. При этом никто не запрещает работодателям продолжить принимать от работников заявления о выдаче необходимых денежных сумм. Однако, имейте в виду, что порядок выдачи ассигнований следует закрепить в
положении о выдачи денежных средств подотчет.Вы можете скачать пример положения о выдаче подотчетных денежных средств.
Сроки выдачи денежных средств
Какие сроки выдаче денежных средств подотчет? Когда сотрудникам нужно сдать работодателю отчет о потраченных денежных средствах? Ответ на этот вопрос нужно искать в приказе генерального директора. Ведь именно в нем обозначается такой срок.
По общему правилу, сотрудник должен отчитаться по суммам, полученным под отчет, не позднее трех рабочих дней после истечения срока, на который эти суммы были выданы (п. 6.3 Указания ЦБ РФ от 11.03.2014 № 3210-У). Но что делать, если срок возврата установлен не был? По мнению налоговиков, в такой ситуации сотрудник должен сдать отчет в тот же день, в который их получил (письмо ФНС России от 24.01.2005 № 04-1-02/704).
Отчет по командировочным
Специальные условия определены для командировочных расходов. Отчитаться по ним работник должен в течение трех рабочих дней со дня возвращения из командировки (п.
26 Положения, утв. Постановлением Правительства РФ от 13.10.2008 № 749).
Процесс выдачи денег
Для выдачи денег работодателю нужно действовать так:
- оформите расходный кассовый ордер (РКО). Его должен подписать главный бухгалтер или иное уполномоченное лицо (пп. 4.2, 4.3 п. 4 Указания № 3210-У).
- после того как подотчетник поставит свою подпись на РКО, кассир выдает ему деньги из кассы и подписывает РКО (пп. 6.2 п. 6 Указания № 3210-У).
- оформите выдачу денег под отчет проводкой (статья движения денежных средств):
| Проводка | Операция |
| Д 71 — К 50 | Работнику выданы деньги под отчет |
Вот образец РКО на выдачу денежных средств подотчет:
Выданные под отчет деньги не облагаются НДФЛ и страховыми взносами.
Выдавать наличные деньги под отчет можно если сотрудник не погасил задолженность по ранее выданным денежным средства.
Так можно поступать с 19 августа 2017 года. Однако это не означает, что оформлять авансовые отчеты по израсходованным сумма работникам больше не нужно. Даже после 19 августа 2017 года (например, в 2020 году) о потраченных деньгах работник должен передать в бухгалтерию отчетные документы.
Стоит заметить, что выдача денежных средств в подотчет учредителю или директор не запрещена. Однако стоит понимать, что никаких «поблажек» для руководителей в этой части не предусмотрено. Так, например, учредитель, как и любой другой сотрудник, обязан вернуть полученные подотчетные средства.
Бланк авансового отчета — Оператор фискальных данных Первый ОФД
Бланк авансового отчета
Для учета средств, которые выдаются сотрудникам организации для выполнения какого-либо служебного долга, например командировки или закупки ГСМ для транспорта, бухгалтерией оформляется авансовый отчет. Авансовый отчет — это локальный нормативный акт, регулирующий оборот наличных денежных средств для выдачи подотчетным лицам.
Какая информация необходима для составления авансового отчета?
В список нормативных документов, подлежащих сдаче в авансовой отчетности входят:
- положение о расчетах с подотчетными лицами,
- список сотрудников, имеющих право на получение подотчетных средств,
- приказы о служебных командировках,
- заявление работника на выдачу подотчетных сумм с указанием счета для перечисления денег в безналичном порядке.
Выдаются подотчетные суммы только в определенном порядке на основании приказа руководителя предприятия и заявления работника.
Как правило, такие отчеты составляются вручную, или же с помощью специализированных программ, например 1С. Предоставляться форма должна в бухгалтерию в течение 3 дней с момента израсходования средств или возвращения из командировки.
Заявление работника о выдаче авансового отчета
Письменное заявление подотчетного лица, то есть сотрудника, для выдачи ему наличных денег под отчет оформляется в произвольной форме, и должно содержать запись о сумме наличных, которую необходимо выдать, и сроке, на какой период выдаются эти деньги. После составления заявления на нем необходимо оставить подпись руководителя организации и дату. Подпись руководителя и дата на таком заявлении являются обязательными реквизитами.
После составления заявления на нем необходимо оставить подпись руководителя организации и дату. Подпись руководителя и дата на таком заявлении являются обязательными реквизитами.
Отметим, что форма заявления не предусмотрена нормативным актом и потому заявление составляется произвольно (с отражением всех необходимых сведений) либо утверждается в ЛНА компании.
В заявлении также еще должна содержаться информация об отсутствии задолженности за подотчетным лицом.
Это обязательное требование к подотчетному лицу: выдача наличных денег под отчет проводится при условии полного погашения с его стороны задолженности по ранее полученной под отчет сумме наличных денег (абз. 3 п. 6.3 Указания N 3210-У). Таким образом, если сотрудник еще не отчитался по выданному ранее авансу, выдать ему новый нельзя.
Как заполнять авансовый отчет?
Бланк заполнения отчета образца 2018 года вы можете скачать здесь. Расскажем, как его необходимо заполнить, чтобы документ считался корректным.
На лицевой стороне формы № АО-1 необходимо указать следующие данные:
- наименование организации, которая выдавала денежные средства под отчет, коды по ОКПО и ОКУД;
- номер и дата составления отчета;
- данные подотчетного лица: ФИО и должность;
- наименование структурного подразделения.
На обратной стороне формы № АО-1 указать следующие данные:
- сумму расхода по отчету;
- назначение аванса;
- информация об остатке/перерасходе аванса;
- билеты, кассовые и товарные чеки, квитанции и т. д.;
- количество приложенных оправдательных документов;
- подписи руководителя, главного бухгалтера, бухгалтера;
- расписка подотчетного лица с личной подписью.
При этом, в федеральном законе №402 “О бухгалтерском учете” не указана конкретная информация о требованиях обязательного применения унифицированных форм авансовых учетных документов. Поэтому у организаций есть выбор: либо самостоятельно разработать форму отчетов, либо воспользоваться унифицированной формой № АО-1, утвержденной постановлением Госкомстата России от 01.08.2001 № 55.
Поэтому у организаций есть выбор: либо самостоятельно разработать форму отчетов, либо воспользоваться унифицированной формой № АО-1, утвержденной постановлением Госкомстата России от 01.08.2001 № 55.
Персональные данныеСоветы для предпринимателей
Подача заявки | SAMHSA
Требуется: электронная подача заявки на грант
Сроки подачи
Выделите достаточно времени, чтобы подготовить и подать заявку. SAMHSA рекомендует подавать электронное заявление от 24 до 48 часов до истечения срока подачи заявления. Если возникнут какие-либо технические проблемы, это дополнительное время должно позволить вам решить их и повторно подать заявку в установленный срок.
Grants.gov отклонит заявки, поданные после 23:59 (по восточному времени) в установленный срок.
Требуемые форматы файлов и вложения
Чтобы узнать, какие файлы вы должны включить в свою заявку, обратитесь к разделу «Заявление и подача» в Уведомлении о возможности финансирования (NOFO), Часть I, и в разделе «Как подать заявку» в NOFO, Часть II. NOFO также предоставит инструкции по форматированию каждого вложения.
NOFO также предоставит инструкции по форматированию каждого вложения.
Чего ожидать после отправки
После того, как Grants.gov получит вашу заявку, вы получите сообщения электронной почты о ходе рассмотрения вашей заявки.Вы должны получить три отдельных письма (как описано в разделе «Подача заявки на Grants.gov»):
- Первое письмо для квитанции об отправке только . Он подтверждает получение вашей заявки системой Grants.gov и предоставляет вам номер для отслеживания и ссылку «Отследить мою заявку». Это сообщение не означает, что заявка принята .
- Второе электронное письмо уведомляет вас о том, что ваша заявка была успешно подтверждена грантами.gov (до передачи в агентство) или был отклонен из-за ошибок. Это критическое замечание. Новые кандидаты получают первое электронное письмо и часто ошибочно предполагают, что подача их заявки в SAMHSA была завершена.
Примечание. Заявки, успешно поданные через Grants.
 gov, поступят в систему eRA NIH и пройдут серию проверок, чтобы убедиться, что вся необходимая информация включена и в соответствующем формате. Как только ваша заявка будет успешно подтверждена системой NIH eRA, она будет отправлена в SAMHSA как принимающее учреждение для дальнейшего рассмотрения.
gov, поступят в систему eRA NIH и пройдут серию проверок, чтобы убедиться, что вся необходимая информация включена и в соответствующем формате. Как только ваша заявка будет успешно подтверждена системой NIH eRA, она будет отправлена в SAMHSA как принимающее учреждение для дальнейшего рассмотрения. - Третье электронное письмо уведомляет вас о том, что SAMHSA получила вашу заявку от Grants.gov. Это электронное письмо может быть получено в течение нескольких часов или нескольких дней после второго электронного письма.
Устранение неполадок при подаче заявки
Следите за своей заявкой, чтобы убедиться, что она успешно получена и проверена как Grants.gov, так и системой eRA NIH. Если это не так, Grants.gov и система eRA NIH не пересылают его в SAMHSA.
Если у вас возникли проблемы с электронной подачей заявки через Grants.gov, обратитесь в службу поддержки Grants.gov по телефону:
Устранение неполадок пакетов приложений предоставляет дополнительные советы.
Если вы не получили номер для отслеживания Grants.gov после подачи заявки, вам следует немедленно связаться со службой поддержки Grants.gov.
Технические проблемы с Grants.gov могут помешать успешной подаче заявки. В этом случае получите на Grants.gov номер дела / заявки / справки, в котором задокументированы проблемы. Если технические проблемы с Grants.gov мешают успешной онлайн-подаче, этот ссылочный номер является единственной документацией, которую SAMHSA примет для особого рассмотрения, чтобы разрешить подачу бумаги.SAMHSA не уделяет особого внимания ошибкам, допущенным заявителем.
Дополнительная поддержка также доступна в службе поддержки NIH eRA:
- Отправьте веб-билет: http://grants.nih.gov/support/index.html
- Телефон: 301-402-7469 или (бесплатно) 1-866-504-9552. Служба поддержки NIH eRA работает с понедельника по пятницу с 7:00 до 20:00. Восточное время, кроме государственных праздников
Контрольный список для регистрации новых соискателей гранта
SAMHSA настоятельно рекомендует любой организации, намеревающейся подать заявку на грант SAMHSA, следовать грантам. Контрольный список регистрации организации gov. Этот контрольный список содержит инструкции по регистрации для компании, учреждения, правительства штата, местного или племенного правительства или организации другого типа, подающей заявку впервые через Grants.gov.
Контрольный список регистрации организации gov. Этот контрольный список содержит инструкции по регистрации для компании, учреждения, правительства штата, местного или племенного правительства или организации другого типа, подающей заявку впервые через Grants.gov.
Отказ от подачи в электронном виде
SAMHSA не принимает бумажные заявки, за исключением особых обстоятельств. Если вам нужно особое внимание, SAMHSA должна заранее утвердить отказ от этого требования.
Если у вас нет технологии для подачи заявки через Интернет или ваше физическое местоположение имеет плохое подключение к Интернету, вы можете запросить отказ от подачи электронной заявки.Вы должны отправить письменный запрос не менее чем за 15 календарных дней до срока подачи заявки.
С любыми вопросами обращайтесь в Отдел рассмотрения грантов по телефону 240-276-1199.
Подать заявку
Пользователи с соответствующими привилегиями могут отправить заявку в электронном виде через ASSIST.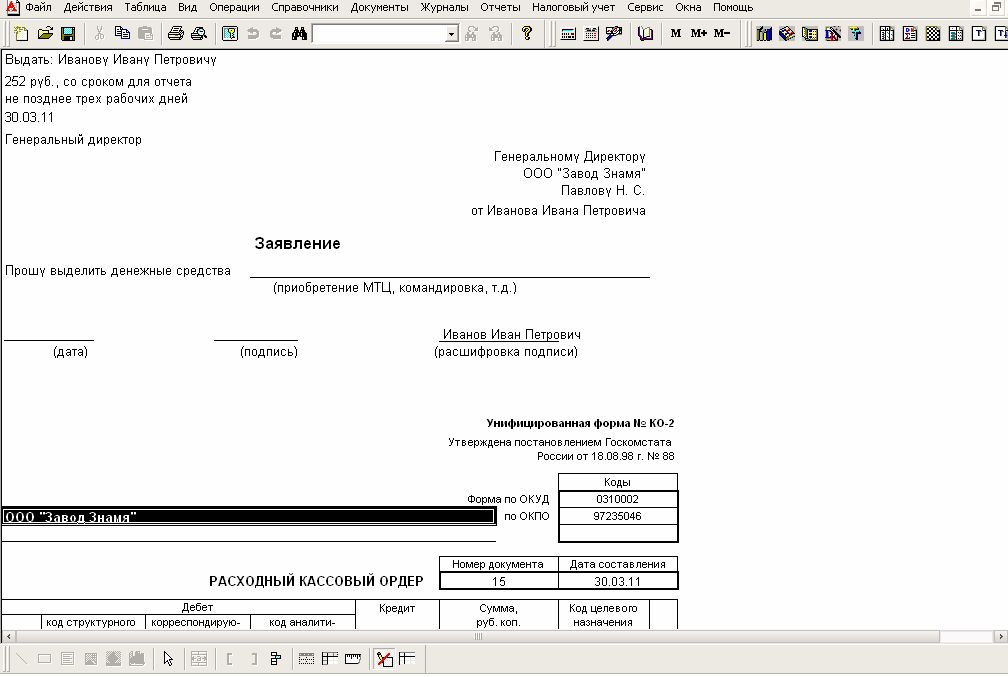 Чтобы заявка была подана, ее статус должен быть «Готово к подаче». Приложение может быть обновлено до статуса «Готово к отправке» только после того, как оно прошло все системные и бизнес-проверки.
Чтобы заявка была подана, ее статус должен быть «Готово к подаче». Приложение может быть обновлено до статуса «Готово к отправке» только после того, как оно прошло все системные и бизнес-проверки.
После отправки у вас будет окно просмотра приложения в течение 2 рабочих дней, чтобы проверить собранное приложение и изменить отправленное приложение . Ваше приложение автоматически переходит к сотрудникам, занимающимся квитанциями и направлениями, для дальнейшей обработки после того, как окно просмотра приложения истечет, если вы явно не «отклоните» приложение в модуле состояния eRA Commons.
Если вы отправили административное дополнение, подписывающий чиновник может пропустить двухдневное окно просмотра, щелкнув ссылку Проверить в модуле статуса для приложения.Подробнее см. Этот раздел в справке eRA Commons.
Следуйте приведенным ниже инструкциям для подачи заявки на несколько проектов или заявки на один проект, в зависимости от ситуации. Также см. «Отправка, отслеживание и просмотр вашей заявки».
Также см. «Отправка, отслеживание и просмотр вашей заявки».
Подача заявок на несколько проектов
Для подготовки мультипроектной заявки к подаче:
- Убедитесь, что хотя бы один компонент приложения находится в состоянии «Окончательный», а другие компоненты — в состоянии «Окончательный» или «Прервано».
- Убедитесь, что приложение имеет статус «Все компоненты окончательно».
Выполните проверку приложения с помощью кнопки «Проверить приложение» в разделе «Действия».
Когда приложение проходит проверку, его статус обновляется до Все компоненты проверены.
- Обновите приложение до состояния «Готово к отправке» с помощью кнопки «Обновить статус отправки» в разделе «Действия».
Для подачи заявки:
Только официальное лицо ведущей организации-заявителя, которое является уполномоченным представителем организации, может подать заявку.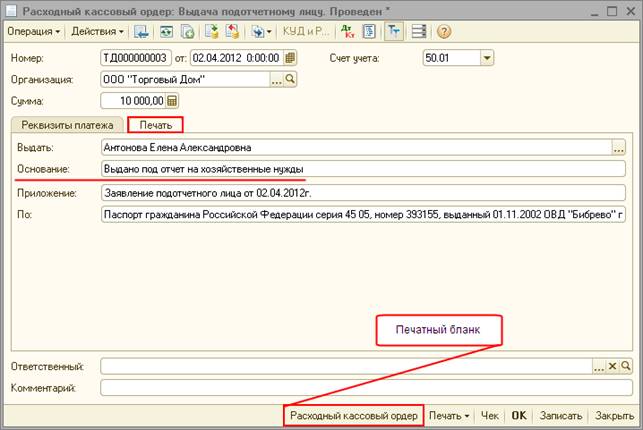
Когда приложение находится в состоянии «Готово к отправке», нажмите кнопку «Отправить приложение» на экране «Информация о приложении». Кнопка расположена рядом с полем «Статус» и активна только в том случае, если приложение находится в состоянии «Готово к отправке».
ASSIST запрашивает у пользователя учетные данные уполномоченного представителя организации (AOR) Grants.gov.
Введите учетные данные AOR в поля «Имя пользователя» и «Пароль» и нажмите кнопку «Ввод».
ПРИМЕЧАНИЕ. — это учетные данные Grants.gov, а , а не — учетные данные ASSIST или eRA Commons.
Информация передается от ASSIST грантам.gov для дальнейшей обработки. В ASSIST статус приложения обновляется до состояния «Отправлено».
 Дата и время подачи записываются. Эти сведения можно просмотреть на странице «Просмотр истории состояний». Кроме того, ASSIST отправляет уведомление соответствующим сторонам, чтобы проинформировать их о том, что заявка подана. Это включает SO и PD / PI.
Дата и время подачи записываются. Эти сведения можно просмотреть на странице «Просмотр истории состояний». Кроме того, ASSIST отправляет уведомление соответствующим сторонам, чтобы проинформировать их о том, что заявка подана. Это включает SO и PD / PI.
Подача заявок на отдельные проекты
Для подготовки заявки к подаче:
Необязательно: Выполните проверку приложения с помощью кнопки «Проверить приложение» в разделе «Действия».
- Обновите приложение до состояния «Готово к отправке» с помощью кнопки «Обновить статус отправки» в разделе «Действия».
- Необязательно: оставьте комментарий, если хотите.
Для подачи заявки:
Только официальное лицо ведущей организации-заявителя, которое является уполномоченным представителем организации, может подать заявку.
Обновите приложение до состояния «Готово к отправке» с помощью кнопки «Обновить статус отправки» на панели «Действия».
ASSIST выполняет проверки при обновлении статуса. Если приложение не проходит проверку, все ошибки и предупреждения отображаются на странице «Ошибки приложения и результаты предупреждений», которая открывается в отдельном окне. Перед подачей заявки необходимо исправить ошибки.
ВАЖНО: Хотя вы можете подавать заявку с существующими предупреждениями, обязательно ознакомьтесь со всеми предупреждениями и исправьте необходимые элементы.
- Когда приложение находится в состоянии готовности к отправке, нажмите кнопку «Отправить приложение» в области «Действия».
ASSIST запросит у вас полномочия уполномоченного представителя организации Grants.
 gov (AOR).
gov (AOR). Введите учетные данные AOR в поля «Имя пользователя» и «Пароль» и нажмите кнопку «Ввод».
ПРИМЕЧАНИЕ: Это гранты.gov и учетные данные , а не , учетные данные ASSIST или eRA Commons.
Информация передается из ASSIST в систему Grants.gov для дальнейшей обработки. В ASSIST статус приложения обновляется до состояния «Отправлено». Дата и время подачи записываются. Эти сведения можно просмотреть на странице «Просмотр истории состояний». Кроме того, ASSIST отправляет уведомление соответствующим сторонам, чтобы проинформировать их о том, что заявка подана.Это включает SO и PD / PI.
Была ли эта информация полезной? Есть ли какие-либо комментарии или предложения по поводу информации, представленной в этой теме? Присылайте свои комментарии об онлайн-справке ASSIST по адресу.
Обучение: подача заявок | JUSTICEGRANTS
Описание
Ключевая аудитория: Заявитель JustGrants, администратор организации
Кандидаты, подающие заявку на финансирование Министерства юстиции (DOJ), могут просмотреть видеоролики с электронным обучением, справочное руководство, Контрольный список для заявлений в DOJ и другие ресурсы, чтобы узнать больше о том, как успешно ориентироваться в процессе подачи заявки.Кандидаты должны начать процесс подачи заявки на Grants.gov. После подачи заявки на Grants.gov информация о заявке и формы будут переданы в JustGrants и автоматически появятся, когда вы войдете в свою заявку в JustGrants.
Видео с электронным обучением и другие учебные ресурсы объясняют —
- шагов, которые необходимо предпринять перед подачей заявки на финансирование;
- , как найти открытые возможности финансирования Министерства юстиции на Grants.gov;
- как подать заявку на финансирование с помощью JustGrants;
- роли JustGrants, их обязанности и необходимые действия;
- , как перемещаться и использовать JustGrants, чтобы—
- подайте заявку,
- найти приложение,
- заполнить аннотацию предложения и описание предложения,
- заполнить форму подробного бюджета,
- загружают вложения и
- просмотреть, заверить и подать заявку; и
- , где можно найти дополнительные учебные материалы, рабочие пособия и другие ресурсы.
Электронные обучающие видео для подачи заявок
При выборе названия обучающего видео раздел расширяется.
Механика нанесения: подготовка к подаче заявки (НОВИНКА)
Узнайте, как подключиться и зарегистрироваться в JustGrants, включая соответствующие роли участвующих организаций.
Ознакомьтесь с Условиями использования YouTube и Политикой конфиденциальности Google.
Обучающее видео: Механика нанесения: подготовка к подаче заявки; Продолжительность видео: 8:30Механика подачи заявок: начало подачи заявок в грантах.gov (НОВИНКА)
Узнайте, как подать заявку на Grants.gov.
Ознакомьтесь с Условиями использования YouTube и Политикой конфиденциальности Google.
Обучающее видео: Механика подачи заявок: начало подачи заявки на Grants.gov; Продолжительность видео: 8:35Подача заявки: поиск заявки
Подача заявки: подача заявки
Подача заявки: заполнение формы с подробным бюджетом
Механика приложения: после подачи заявки (НОВИНКА)
Узнайте, чего ожидать после отправки полной заявки в JustGrants.
Ознакомьтесь с Условиями использования YouTube и Политикой конфиденциальности Google.
Обучающее видео: Механика применения: после подачи заявки; Продолжительность видео: 6:37Стандартные образцы
Ниже приводятся дополнительные пояснения, определения и визуальные представления процессов и информации.
Контрольный список для подачи заявок в DOJ охватывает все необходимые шаги для завершения двухэтапного процесса подачи заявок в грантах.gov и JustGrants. Контрольный список включает информацию по:
- как подготовиться к подаче заявления;
- заполнив сокращенную заявку на Grants.gov
- Регистрация лиц и доступ к JustGrants;
- процесс адаптации JustGrants;
- заполнение, рассмотрение, сертификация и подача вашей заявки в JustGrants; и
- полезных советов для пользователей.
В качестве дополнения к материалам для самостоятельного обучения откройте презентацию на веб-семинарах «Механика приложений: отправка заявки», которые команда JustGrants проводила с февраля по апрель 2021 года.Вы также можете обратиться к , двум виртуальным сеансам вопросов и ответов по подаче заявок и принятию наград, команда JustGrants провела в октябре 2020 года. Презентации сеансов, записи и ответы на часто задаваемые вопросы доступны на странице виртуальных сеансов вопросов и ответов .
Английскийсуществительное( ru имя существительное )Ed Pilkington «Роботы-убийцы» следует запретить заранее, заявили в ООН. , пассаж = В своем представлении в ООН [Кристоф] Хейнс указывает на опыт использования беспилотных летательных аппаратов. Беспилотные летательные аппараты изначально предназначались только для наблюдения, и их использование в наступательных целях было запрещено, но, как только стратеги осознали свои предполагаемые преимущества в качестве средства проведения целенаправленных убийств, все возражения были устранены.}} Синонимы* ( акт подачи ) молчаливое согласие, капитуляция, уступка, сдача, подчинение, подчинение, уступка * ( штука отправлена )Антонимы* ( акт подачи ) восстание, контроль | Английскийсуществительное( ru имя существительное )
Гипонимы* Смотрите такжеСинонимы* ( компьютерное программное обеспечение ) ПО, программаСписок литературы* WordNet 3.0 [http://wordnet.princeton.edu/perl/webwn?s=application]. —- |
Подача и заполнение вашей Cal State Подайте заявку
Перед подачей
Прежде чем подавать заявку, имейте в виду следующее:
- После подачи заявки вы не можете вносить никаких изменений.
- Просмотрите и подтвердите кампус (ы), программу (ы) и условия подачи заявки, чтобы обеспечить точность.
- Не ждите до последней минуты. Вы можете подать заявку до 23:59 по тихоокеанскому времени в установленный срок; Тем не менее, убедитесь, что у вас есть время, чтобы заполнить требуемый платежный раздел. Вы должны нажать Отправить и заполнить окончательную информацию о платеже до истечения крайнего срока, чтобы гарантировать, что ваша заявка будет принята. Кроме того, имейте в виду, что в самое загруженное время у вас могут возникать задержки загрузки страниц, и это может происходить в нерабочее время службы поддержки клиентов. Мы не можем продлить сроки, если вы пропустите свой срок; свяжитесь с вашими программами напрямую для получения дополнительной информации.
Отказ от уплаты сбора за подачу заявления
Перед подачей заявки ознакомьтесь с разделом «Заявление об отказе от платы» штата Калифорния, чтобы узнать, имеете ли вы право на доступную отмену платы.
Если вы имеете право на отказ от уплаты сбора за подачу заявления, вы увидите ссылку Check My Fee Waivers на странице Подача заявки . Щелкните Проверить мои отказы от уплаты для получения дополнительной информации.
Коды приглашений
Некоторые программы предоставляют коды приглашений, которые представляют собой продление сроков, предлагаемых отдельным заявителям.Если вы получили код приглашения от программы, используйте информацию ниже, чтобы подать заявку на программу, срок которой уже истек.
Вы можете применить свой код (ы) приглашения, когда выбираете программу (см. Раздел Выбор штата Калифорния Применить программы ) или готовы подать заявку (шаги ниже). Обратите внимание, что вы должны использовать код приглашения до истечения срока действия (т. Е. Новой даты крайнего срока).
Отправка в программу
- Щелкните вкладку «Отправить заявку» вверху приложения.
- Щелкните ссылку Введите код приглашения для закрытой программы.
- Введите код приглашения, полученный от программы.
- Щелкните Отправить. Чтобы отправить в несколько программ, нажмите Отправить все .
Сводка по применению, стр.
После того, как вы нажмете Отправить , вы попадете на страницу сводной информации о приложении. На странице «Сводная информация о приложении» представлены основные академические области вашего приложения.Обязательно внимательно изучите этот раздел перед отправкой.
Отправка платежа
Когда вы будете готовы подать заявку, перейдите на вкладку «Отправить заявку» и нажмите Отправить . Не отправляйте никаких платежей до подачи заявки. Платежи в приложении можно производить только через PayPal, предоплаченную кредитную или дебетовую карту, а также стандартную дебетовую или кредитную карту. Мы принимаем карты Visa, Mastercard, American Express и Discover. Оплата кредитной картой не может производиться по телефону.
Если вы выбрали оплату через PayPal, после завершения транзакции через PayPal вы должны вернуться в свое приложение Cal State Apply и нажать Submit . Обратите внимание, что вы можете добавить деньги на свой счет PayPal в определенных точках розничной торговли. Посетите веб-сайт PayPal для получения информации о местонахождении и информации.
После отправки заявки и оплаты щелкните Просмотреть историю платежей для каждой программы на странице «Отправить заявку», чтобы подтвердить получение платежа.
После отправки
Вы получите электронное письмо с подтверждением того, что ваша заявка была отправлена.Обратите внимание, что отправка не означает, что ваше приложение проверяется вашими программами. Обязательно следите за своим статусом на странице Проверить статус .
Вы можете просмотреть свои платежные реквизиты на странице Подача заявки для каждой программы, в которую вы подали заявку.
Заполнение статуса Cal State Подайте заявление
Как правило, заявка считается заполненной, когда:
- Все необходимые рекомендации были выполнены и отправлены в Cal State Apply.
- Ваш платеж за регистрацию был отправлен и отмечен как полученный.
- Вы отправили заявку и получили электронное письмо, подтверждающее ее успешную отправку.
Обратите внимание, что выбранные вами программы могут иметь особые требования для завершения (например, дополнительные приложения, официальные стенограммы, загрузка документов и т. Д.). Мы рекомендуем напрямую связываться с вашими программами, чтобы убедиться, что вы выполняете все требования. Непредставление всех необходимых материалов может поставить под угрозу ваше право на рассмотрение при поступлении.Просмотрите домашнюю страницу каждой программы, чтобы убедиться, что вы соответствуете всем требованиям.
Руководство по заполнению формы заявки на лекарство
Обновлено: 31 марта 2021 г.
Руководство
Для заявок на получение идентификационного номера лекарственного средства необходимо предоставить отдельный заполненный HC / SC 3011 для каждого состава, силы и лекарственной формы. Для всех других типов заявок должна быть предоставлена только отдельная заполненная Часть 2 для каждого состава, дозировки и лекарственной формы.
Примечание: Дополнительная или дополнительная информация к уже поданной заявке должна сопровождаться только копией письма из Министерства здравоохранения Канады с запросом дополнительной информации.
Куда отправлять заявки на лекарственные препараты
Лекарства для человека
Заявки на клинические испытания и поправки к лекарственным средствам для людей следует направлять непосредственно в соответствующее управление следующим образом:
Фармацевтические препараты
Управление клинических исследований
Управление терапевтических продуктов
5-й этаж, Holland Cross, Tower B
Локатор адресов: 3105A
1600 Скотт-стрит,
Оттава, Онтарио, Канада
K1A 0K9
Биологические / радиофармацевтические препараты
Управление биологии и генетической терапии,
Отдел нормативно-правового регулирования
Министерство здравоохранения Канады
Локатор адресов: 0701A
200 Tunney’s Pasture Driveway
Оттава, Онтарио, Канада
K1A 0K9
Все остальные виды лекарств следует отправлять по адресу:
Управление подачи заявок и интеллектуальной собственности, Управление ресурсов и операций Управление здравоохранения Канады
Финансовый корпус
Подъездной путь к пастбищам Танни, 101,
Локатор адресов: 0201A1
Оттава, Онтарио
Канада
K1A 0K9
Ветеринарные препараты
Для получения инструкций о том, как подавать заявки на ветеринарные препараты, отправьте электронное письмо в Отдел приема заявок и управления знаниями по адресу [email protected].
Часть 1 — Информация о производителе / спонсоре и лекарственном препарате
Секция № 1-4
Направляющая
Только для использования в Министерстве здравоохранения Канады
Секция № 5
Выберите класс продукта. Допустимые записи:
- Человек
- Ветеринария
- Дезинфицирующее средство
Тип заявки, направляемой в Министерство здравоохранения Канады.Допустимые записи:
- Заявка на клиническое исследование (CTA)
- Заявка на клиническое испытание — Поправка (CTA-A)
- Новый исследуемый ветеринарный препарат (VIND)
- Поправка к ветеринарным исследованиям новых лекарственных средств (VIND-AM)
- Заявка на новый препарат (NDS)
- Представление новых лекарств для дезинфицирующих средств (NDS-D)
- Представление новых ветеринарных препаратов (VNDS)
- Приложение к заявке на новые лекарства (SNDS)
- Дополнение к заявке на новые лекарственные средства для дезинфицирующих средств (SNDS-D)
- Приложение к заявке на новый препарат — подтверждающее (SNDS-c)
- Дополнение к сокращенному заявлению о новом лекарстве — Подтверждающее (SANDS-c)
- Ветеринарная добавка к заявке на новый лекарственный препарат (VSNDS)
- Сокращенное представление новых лекарств (ANDS)
- Ветеринарная сокращенная заявка на новые лекарства (VANDS)
- Дополнение к сокращенной заявке на новые лекарства (SANDS)
- Ветеринарная добавка к сокращенной заявке на новые лекарства (VSANDS)
- Заявка на выдачу новых лекарств для чрезвычайных ситуаций (EU NDS)
- Дополнение к заявке на новый лекарственный препарат для чрезвычайных ситуаций (ЕС SNDS)
- Сокращенное представление новых лекарств для чрезвычайных ситуаций (EU ANDS)
- Дополнение к сокращенной заявке на новые лекарства для чрезвычайных ситуаций (EU SANDS)
- Уведомляемое изменение — для изменений качества биологических радиофармацевтических препаратов (NC)
- Изменения, подлежащие уведомлению в ветеринарии (VNC)
- Заявление на получение идентификационного номера лекарственного средства для фармацевтического продукта, включая безрецептурные продукты, подтверждающие соответствие стандарту маркировки (DINA) Сноска 1
- Заявление на получение идентификационного номера лекарственного средства для продукта Монографии категории IV (DINF) Сноска 1
- Заявление на получение идентификационного номера лекарственного средства для биологического продукта (DINB) Сноска 1
- Заявление на получение идентификационного номера лекарственного средства для дезинфицирующего средства (DIND) Сноска 1
- Подача идентификационного номера ветеринарного препарата — все типы (V-DIN) Сноска 3
- Изменение после авторизации Подразделения 1 (PDC) Сноска 2
- Изменение подразделения 1 после получения разрешения на биологический лекарственный препарат (PDC-B) Сноска 2
- Ветеринарный пост-авторизационный отдел 1 Изменение — изменение на DIN (VPDC) Сноска 2
- Административное название производителя / изменение названия продукта / лицензионные соглашения (ADMIN)
- Ветеринарная администрация наименование производителя / изменение названия продукта / лицензионные соглашения (VADMIN)
- AP-поправка к временному распоряжению о COVID-19 (COV19A) (неприменимо для заявок на клинические испытания) Footnote 4
- Заявка на временный заказ на COVID-19 (COV19) (Не применяется для заявок на клинические испытания) Сноска 4
- Ветеринарная поправка к Временному приказу о COVID-19 (VCOV19A) (не применяется для клинических испытаний) Сноска 4
- Ветеринарная заявка на временный заказ на COVID-19 (VCOV19) (не применяется для заявок на клинические испытания) Сноска 4
- Подача заявки на новый препарат с гибкими возможностями для назначенного препарата COVID-19 (NDS CV)
- Подача заявок на новые ветеринарные препараты с гибкими возможностями для назначенного препарата COVID-19 (VNDS CV)
Секция № 6
Руководство
Если возможно, укажите количество томов, содержащихся в заявке на лекарство.Укажите количество исходных томов, а затем количество дублирующих томов.
Секция № 7
Руководство
График: Заполните, только если лекарство включено в Список C (радиофармпрепараты) и / или Список D (биологические препараты) в Закон о пищевых продуктах и лекарствах , Список F (рецептурные препараты) в Положения о пищевых продуктах и лекарствах и укажите, подпадает ли продукт под действие Закона о контролируемых лекарствах и веществах (CDSA).
Статус по рецепту: Определите, является ли препарат рецептурным
Секция № 8
Руководство
Бренд или собственное наименование или название продукта — это название, присвоенное производителем / спонсором для обозначения лекарственного средства (продукта) и под которым препарат будет продаваться / рекламироваться. Торговая марка также является названием, используемым для идентификации продукта во всей переписке, связанной с подачей заявки, а также на этикетке (ах) продукта и в описании продукта / вкладыше к упаковке, если применимо.Если название бренда еще не определено, например В материалах CTA, VIND или NDS может использоваться собственное или общепринятое название препарата или код исследования.
Для подачи заявки на клиническое исследование введите название исследуемого продукта, и если имеется более одного исследуемого продукта , все они должны быть отражены, и для каждого из них должна быть заполнена отдельная Часть 2. (Примечание: исследуемый продукт соответствует продукту, участвующему в проведении клинического исследования.Это может быть продукт, недоступный в Канаде, продукт в разработке или продукт, уже одобренный в Канаде, но используемый вне утвержденных показаний.)
Если после подачи заявки NDS, ANDS, DIN, VNDS, VANDS или VDIN, но до завершения рассмотрения заявки , вы хотите изменить торговую марку, указанную в поданной форме заявки, отправьте письменное уведомление о предлагаемое изменение на тот же адрес, на который была отправлена исходная заявка (см. титульный лист), с указанием номера заявки и исходного названия продукта. Если вы хотите изменить название продукта после подтверждения заявки, см. Политику Министерства здравоохранения Канады «Изменения названия производителя и / или названия продукта».
Секция № 9
Руководство
Имя собственное для продукта — это название, присвоенное лекарственному средству в Разделе C.01.002 Правил по пищевым продуктам и лекарствам , или выделенное жирным шрифтом в других разделах Правил или название препарата в его готовая форма, указанная в названии монографии или в любой из официальных публикаций, перечисленных в Приложении B к Закону о пищевых продуктах и лекарствах .
Пример: ацетаминофен
.
Таблетки сульфата железа
Общее название — это название, под которым лекарственное средство с одним ингредиентом обычно известно / обозначается в научных или технических журналах , кроме публикаций, упомянутых в Списке B к Закону о пищевых продуктах и лекарствах. Общее название включает фармацевтическую форму при использовании по отношению к готовому лекарственному продукту.
Если имя собственное отсутствует и лекарство состоит из одного лекарственного ингредиента, введите общее название.Если собственного названия нет и лекарство состоит из более чем одного лекарственного ингредиента, оставьте Раздел 9 пустым. Для клинического исследования должны быть перечислены все действующие вещества. Если продукт состоит из более чем одного ингредиента, следует выделить собственное название ингредиентов и разделить их косой чертой (/).
Раздел №
Блок А
Руководство
Информация о производителе / спонсоре: Информация, которая должна быть предоставлена в блоке A (10-23), относится к производителю / спонсору, на имя которого подается заявка на лекарство, и если идентификационный номер лекарства (DIN) / Уведомление о соответствии ( NOC), компания, на имя которой будет зарегистрирована DIN / NOC, (т.e., владелец DIN / NOC), имя которого должно быть указано на этикетке продукта и в монографии продукта / вкладыше к упаковке.
Для CTA и CTA-As спонсор определяется Разделом 5, Часть C Правил по пищевым продуктам и лекарствам как физическое лицо, юридическое лицо, учреждение или организация, которые проводят клинические испытания. Укажите полное имя спонсора, на имя которого подается тематический CTA или CTA-A. Не сокращайте имя спонсора. Обратите внимание, что спонсором не обязательно является компания, производящая лекарственный препарат.Для CTA и CTA-As, инициированных исследователем: если спонсор определяется как физическое лицо, укажите также название аффилированного учреждения / организации
Для VIND и VIND-AM применяется то же определение спонсора.
Секция № 10
Руководство
Код компании: Если известно, введите 4- или 5-значный код компании, присвоенный Health Canada компании-изготовителю / спонсору e.грамм. 4567. Если не известно, оставьте поле пустым.
Секция № 11
Руководство
Укажите полное название производителя / спонсора, на имя которого подается заявка на лекарственное средство, и, если применимо, , на имя которого должен быть зарегистрирован DIN / NOC. Не сокращайте название компании. Обратите внимание, что производитель / спонсор не обязательно является компанией, производящей лекарственный препарат. Обратите внимание, что не используйте формулировку или сокращение «dba — do business as» в названии производителя / спонсора e.грамм. Hamilton Brothers dba Hamilton Family, они либо идут с Hamilton Brothers или Hamilton Family, либо они могут пойти с Hamilton Brothers, подразделением Hamilton Family.
Если после подачи заявки в NDS, ANDS, DIN, VNDS, VANDS или VDIN и до завершения рассмотрения заявки , вы хотите изменить название производителя / спонсора, отправьте письменное уведомление об изменении по тому же адресу на которую была отправлена оригинальная заявка (см. титульный лист), с указанием номера заявки и оригинального названия производителя / спонсора. Если вы хотите изменить название производителя / спонсора после того, как заявка была одобрена, обратитесь к политике Министерства здравоохранения Канады «Изменения в названии производителя и / или названии продукта». Также обратите внимание, что такое представление административного изменения, которое перекрестно ссылается на исходные NDS, ANDS, VNDS или VANDS, должно быть отправлено и очищено перед изменением имени производителя / спонсора для уже поданного представления SNDS, SANDS, NC, VSNDS, VSANDS или VNC.
Для CTA и CTA-As спонсор определяется Разделом 5, Часть C Правил по пищевым продуктам и лекарствам как физическое лицо, юридическое лицо, учреждение или организация, которые проводят клинические испытания.Укажите полное имя спонсора, на имя которого подается тематический CTA или CTA-A. Не сокращайте имя спонсора.
Обратите внимание, что спонсором не обязательно является компания, производящая лекарственный препарат. Для CTA и CTA-As, инициированных исследователем: если спонсор определяется как физическое лицо, укажите также название аффилированного учреждения / организации. Для VIND и VIND-AM применяется то же определение спонсора.
Секция № 12-16
Руководство
Укажите полный почтовый адрес производителя / спонсора, указанного в Разделе 11.Если используется почтовый адрес, укажите номер квартиры / квартиры (если применимо) в дополнение к улице и номеру улицы (12), городу / поселку (13), провинции / штата (14), стране (15). и почтовый индекс (16). Не разрешается использовать почтовый ящик (PO) вместо улицы / набора для описания адреса производителя / спонсора.
Секция № 17-22
Руководство
Укажите имя основного контактного лица (17), расположенного по адресу (12–16) компании-производителя / спонсора, указанного в Разделе 11, и информацию, необходимую для связи с этим лицом, т.е.д., номера телефона и факса (18-19), должность / должность (21), адрес электронной почты (22) и, если возможно, предпочтительный язык (20).
Операционные и системные требования диктуют, что это имя должно быть одинаковым для всех DIN, зарегистрированных на имя производителя / спонсора, указанного в Разделе 11, если эта компания владеет более чем одним DIN. Обратите внимание, что это НЕ обязательно контактное лицо для подачи заявленного лекарственного средства, но основное контактное лицо для данного производителя / спонсора по указанному адресу .
Из-за кратковременных плановых показателей, связанных с клиническими испытаниями в Канаде, в этом разделе указано другое контактное лицо на случай, если контакт, указанный в блоке B, недоступен.
Раздел №
Блок Б
Руководство
Контактное лицо для подачи рассматриваемого лекарственного средства: Информация, представленная в Блоке B (23-34), относится к контактному лицу, конкретному для подачи рассматриваемого лекарственного препарата , i.е., лицо / компания, которому Министерство здравоохранения Канады должно направлять корреспонденцию по предмету обращения. Чтобы избежать путаницы, Блок B должен быть завершен, даже если контакт подачи идентифицирован под другой ролью.
Секция № 23
Руководство
Введите название компании, к которой принадлежит контактное лицо для подачи заявки на лекарственное средство (т. Е. Является сотрудником). Если контакт не принадлежит компании, введите имя контакта.
Секция № 24-28
Руководство
Введите адрес компании, указанной в Разделе 23. Если используется почтовый адрес, укажите номер квартиры / квартиры (если применимо) в дополнение к улице и номеру улицы (24), городу (25), провинция / штат (26), страна (27) и почтовый индекс (28). Включите номер почтового ящика (24), если используется почтовый ящик.
Секция № 29-34
Руководство
Укажите имя контактного лица для подачи заявки на лекарственное средство (29), i.д., имя человека, которому Министерство здравоохранения Канады должно направлять корреспонденцию о подаче рассматриваемого лекарственного препарата. Предоставьте информацию, необходимую для связи с этим лицом, например, номера телефона и факса (30-31), должность / должность (33), адрес электронной почты (34) и, если применимо, языковые предпочтения (32). Обратите внимание, что решение о способе переписки принимает Министерство здравоохранения Канады.
Раздел №
Блок С
Руководство
Нормативный почтовый адрес: Информация, предоставляемая в блоке C (35-46), относится к тому, куда и кому Министерство здравоохранения Канады должно направлять нормативную почту , кроме корреспонденции, относящейся к предмету подачи лекарственного средства (Блок B) , e.грамм. ежегодное уведомление, уведомления о поправках к нормативным требованиям / политике, поскольку они применимы к DIN, зарегистрированным на имя производителя / спонсора, указанного в Разделе 11. Отметьте «То же, что и A выше» или, если они отличаются, заполните разделы 35-46. Операционные и системные требования диктуют, что нормативное почтовое имя / адрес должны быть одинаковыми для всех DIN, зарегистрированных на имя производителя / спонсора, указанного в Разделе 11, если эта компания владеет более чем одним DIN.
Для CTA, CTA-As, VIND и VIND-AM отметьте N / A, если блок C не применим.Если установлен флажок «Н / Д», остальные поля должны быть пустыми.
Секция № 35
Руководство
Введите полное название компании, которая будет действовать от имени производителя / спонсора, указанного в Разделе 11, в отношении обработки нормативной почты, отправляемой Министерством здравоохранения Канады, например ежегодное уведомление, уведомления о поправках к нормативным актам / политике, поскольку они применимы к DIN, зарегистрированным на производителя / спонсора, указанного в Разделе 11.
Секция № 36-40
Руководство
Введите адрес компании, указанной в Разделе 36. Если используется почтовый адрес, укажите номер квартиры / квартиры (если применимо) в дополнение к улице и номеру улицы (36), городу (37), провинция / штат (38), страна (39) и почтовый индекс (40). Включите номер почтового ящика (36), если используется почтовый ящик.
Секция № 41-46
Руководство
Укажите имя основного контактного лица, расположенного по адресу, указанному в разделах 36-40, и информацию, необходимую для связи с этим лицом, i.д., номера телефона и факса (42-43), должность / должность (45), адрес электронной почты (46) и, если возможно, предпочтительный язык (44). Обратите внимание, что решение о способе переписки принимает Министерство здравоохранения Канады.
Раздел №
Блок Д
Канадский импортер: отвечает за продажу этого продукта в Канаде. Заполните блок D (47-52), только если адрес производителя / спонсора, указанный в разделах 11-16, НЕ находится в Канаде.Если компания совпадает с компанией, указанной в Разделе 35, отметьте «То же, что и C выше», или, если отличается, заполните каждую часть блока D.
Исключение для CTA и CTA-As , если лекарства для клинических испытаний будут импортироваться в Канаду, импортеры должны быть санкционированы спонсором, независимо от местонахождения спонсора . Приложение 1 должно быть заполнено и представлено для каждого импортера в Канаде. Перечислите каждого соответствующего импортера, уполномоченного импортировать новое лекарство для целей исследования, указанных в заявке.Канадские импортеры должны находиться на территории Канады. Дополнительные сведения см. В «Руководстве для спонсоров клинических испытаний». По мере выявления дополнительных импортеров в Министерство здравоохранения Канады следует направлять дополнительные копии Приложения 1. Если импортер не изменился при подаче поправки к заявке на клиническое исследование (CTA-A), Приложение 1 не нужно повторно подавать.
Секция № 47
Руководство
Введите полное имя канадского импортера.Канадские импортеры должны находиться в Канаде
.Секция № 48-52
Руководство
Введите адрес компании, указанной в Разделе 47. Если используется почтовый адрес, укажите номер квартиры / квартиры (если применимо) в дополнение к улице и номеру улицы (48), городу (49), провинция (50) и почтовый индекс (52). Не редактируйте / не изменяйте название страны «Канада» в разделе 51.
Раздел №
Блок Е
Руководство
Если должен быть выдан DIN или NOC, укажите, на какой из вышеуказанных адресов следует отправлять форму уведомления о лекарствах (DIN) или NOC, т.е.д., адрес в блоках A, B, C или D. Отметьте все возможные варианты.
Секция № 53
Руководство
Где заявки на связанные лекарства (например, CTA, предшествующий CTA-A, CTA, предшествующий NDS, NDS, относящийся к CTA, родительский NDS для SNDS или DIN, предшествующий PDC) упоминаются в заявке предметного лекарственного средства , укажите тип заявки (см. раздел 5 выше), контрольный номер (номер заявки), торговую марку препарата, производителя / спонсора соответствующей заявки, номер файла для соответствующей заявки, дату подтверждения, соответствующие DIN (если есть) и причина соответствующего представления (например,грамм. краткое описание протокола CTA, причины дополнения и т. д.).
Должно быть указано собственное, обычное или непатентованное название, если торговая марка была неизвестна на момент подачи заявки. В этом разделе должны быть перечислены только заявки, указанные в заявке на лекарство. При необходимости продублируйте и заполните раздел 53 полностью.
Связанные DIN (-ы): введите DIN-коды продуктов (если есть), на которые непосредственно влияет текущая подача.Это поможет найти продукт для обновления любых изменений, например, обновления Монографии продукта или другой информации в базе данных лекарственных препаратов (DPD). Если для продукта не существует стандарта DIN, введите «Н / Д», если не применимо.
Часть 2 — Информация о составе лекарственного препарата
Секция № 54
Руководство
Предлагаемый срок годности / срок годности — это период времени в годах и месяцах, до которого лекарственный продукт сохраняет свою активность, чистоту и физические характеристики, указанные на этикетке.
Для CTA, CTA-As, VIND и VIND-AM нет необходимости заполнять этот раздел, если лекарственный продукт, который будет использоваться в клинических испытаниях, продается в Канаде или если исследуемый продукт используется для определения биоэквивалентности. / Исследование биодоступности.
Секция № 55
Руководство
Укажите название страны (стран), где производится / изготавливается конечная лекарственная форма лекарственного препарата, например, если лекарственный препарат находится в лекарственной форме в виде таблетки или раствора, укажите страну (страны), где эта таблетка или решение было сфабриковано.Это не обязательно может быть страна (страны), в которой продукт упакован / маркируется.
Для CTA, CTA-As, VIND и VIND-AM укажите «Н / Д», если производитель исследуемого продукта не является спонсором исследования.
Секция № 56
Руководство
Перечислите лекарственные (активные) ингредиенты, которые способствуют предполагаемому использованию продукта , , по их собственному или общепринятому названию.Если стандарт производства ингредиента соответствует стандарту Компендиума Списка B, используйте применимую аббревиатуру для этого сборника, например Фармакопея США (USP), Британская фармакопея (BP). Если спецификации для производства ингредиентов отклоняются от стандартного стандарта, превышают его или эквивалентны ему, может быть указан стандарт производителя (Mfr Std). Пожалуйста, введите N / A, если для активного ингредиента не существует стандартного стандарта.
Сила активного (ых) ингредиента (ов) должна быть выражена следующим образом:
- Отдельные фармацевтические формы (например,грамм. таблетка) — г или мг / лекарственная форма
- Порошок для перорального применения — г или мг / мл, г или мг на единицу дозы (например, / 5 мл )
- Жидкость для парентерального применения — мг / мл или%
- Жидкость для перорального применения — г или мг / мл, г или мг на единицу дозы (например, / 5 мл)
- Крем, мазь, лосьон и т. Д. — мг или мл / г, г или мг / мл или%
- Порошок для приготовления раствора и др. — единицы / единицы дозировки (например,грамм. / Флакон 20 мл)
В приведенных выше примерах указана сила активного фрагмента доксициклина (поставляемого в виде доксициклина гиклата) и поэтому рассчитывается как основание. В случае беназеприла гидрохлорида указывается сила соли, поэтому прочность не рассчитывается как базовая.
Определите, был ли ингредиент получен от животного / человека. Если ингредиент был получен от животного / человека, заполните и отправьте Приложение 4.
Для заявок на получение идентификационного номера лекарственного средства необходимо заполнить отдельный HC / SC 3011 для каждого состава и дозировки. Для всех других типов заявок только отдельная Часть 2 должна быть продублирована, заполнена и предоставлена для каждого состава и дозировки. Если вся информация для остальных разделов одинакова, то нет необходимости повторять эти разделы для каждой формы силы / дозировки.
Например, если заявка подана на Дивизион 8 (новый препарат) с двумя сильными сторонами (т.например: 5 мг и 10 мг), и единственное различие, касающееся Части 2, — сила, тогда следует продублировать только разделы 56 и 57.
Секция № 57
Руководство
Перечислите немедицинский ингредиент (ингредиенты) аналогично лекарственным (активным) ингредиентам в разделе 56 выше, за исключением того, что не требуется указывать, рассчитывается ли ингредиент как основание или как соль. Перечислите сначала консерванты, а затем красители.Оставшиеся немедицинские ингредиенты должны быть указаны в Разделе C — Другое, и, если применимо, перечислить ингредиенты, используемые в оболочке капсулы, в Разделе D. Для продуктов, регулируемых исключительно в Разделе 1, указать назначение любых немедицинских ингредиентов. включены в Раздел C — Другое на отдельном листе.
Для вариаций состава, относящихся к одному и тому же стандарту DIN (например, несколько ароматизаторов, красителей, ароматизаторов), укажите название варианта и перечислите все немедицинские ингредиенты для каждого типа варианта.
Определите, был ли ингредиент получен от животного / человека. Если ингредиент был получен от животного / человека, заполните и отправьте Приложение 4.
Для CTA, CTA-As, VIND и VIND-AM нет необходимости заполнять этот раздел, если лекарственный продукт, который будет использоваться в клинических испытаниях, продается в Канаде или если исследуемый продукт предназначен для какой-либо биоэквивалентности. / Исследования биодоступности.
Секция № 58
Руководство
Перечислите материал (материалы) животного / человеческого происхождения для каждого отдельного ингредиента лекарственного препарата и / или материала, используемого на любой стадии производства лекарственного препарата, включая вспомогательное вещество или источник технологической добавки из тканей человека и / или животных.
Введите номер CAS (если применимо), название материала и стандарт для материалов, полученных от людей / животных, используемых при производстве продукта. Выберите вариант Да для столбца «Присутствует в окончательной таре», если ингредиент присутствует в последней таре (на основе стандарта качества, применимого к продукту).
Для заявок на клинические испытания для фармацевтических продуктов , Приложение 4 не следует подавать при условии, что в заявку включены необходимая информация или свидетельства.
Секция № 59
Руководство
Выберите подходящий вариант на основе рабочего определения наноматериалов Министерства здравоохранения Канады:
Министерство здравоохранения Канады считает наноматериалом любой произведенный продукт, материал, вещество, ингредиент, устройство, систему или структуру, если:
- Он находится на или в пределах наномасштаба, по крайней мере, в одном пространственном измерении, или;
- Он меньше или больше наномасштаба во всех пространственных измерениях и демонстрирует одно или несколько наноразмерных явлений.
Для целей данного определения:
- Термин «наноразмер» означает от 1 до 100 нанометров включительно;
- Термин «наноразмерные явления» означает свойства продукта, материала, вещества, ингредиента, устройства, системы или структуры, которые можно отнести к их размеру и отличить от химических или физических свойств отдельных атомов, отдельных молекул и объемного материала; и,
- Термин «произведенный» включает в себя инженерные процессы и управление материей и процессами в наномасштабе.
Секция № 60
Руководство
Укажите предлагаемую лекарственную форму (фармацевтическую форму) лекарственного препарата, например: таблетка, капсула, крем, порошок для раствора и др.
Для подачи заявки на идентификационный номер лекарства необходимо заполнить отдельный HC / SC 3011 для каждой лекарственной формы. Для всех остальных типов подачи должна быть продублирована, заполнена и предоставлена только отдельная Часть 2 для каждой лекарственной формы.
Секция № 61
Руководство
Укажите тип используемого контейнера (ов) и предлагаемый размер (а) упаковки, например: флакон, 100 таблеток; туба, 50 г; флакон, 5 мл.
Для CTA, CTA-As, VIND и VIND-AM укажите N / A, поскольку нет необходимости заполнять этот раздел, если информация неизвестна на момент подачи заявки.
Секция № 62
Руководство
Запишите соответствующую терапевтическую и фармакологическую классификацию лекарственного средства, e.грамм. блокатор кальциевых каналов, модификатор биологического ответа, антагонист гистаминовых рецепторов H 2 , дезинфицирующее средство.
Секция № 63
Руководство
Укажите предлагаемые пути введения, например: пероральный, внутривенный, местный и т. д. Для подачи дезинфицирующего препарата в DIN информация, собранная в этом разделе, касается его использования, как указано в разделе 65, поэтому спонсор может ввести «Обратитесь к разделу 65» вместо заполнения дезинфицирующего средства.
Секция № 64
Руководство
Укажите, является ли лекарственный продукт биологическим / радиофармацевтическим, фармацевтическим, дезинфицирующим средством или комбинацией лекарственного средства и медицинского устройства. Если продукт представляет собой комбинацию лекарственного средства и медицинского устройства, также укажите, какой это лекарственный препарат, например биологические / радиофармацевтические или фармацевтические.
Секция № 65
Руководство
Укажите, предназначено ли лекарство для человека (педиатрическое или взрослое население — выберите оба варианта, если применимо), или для ветеринарного применения, или в качестве радиофармпрепарата, или в качестве дезинфицирующего средства.
Педиатрические группы : термин, определенный в Правилах о пищевых продуктах и лекарствах (C.08.004.1) следующим образом: недоношенные дети, родившиеся до 37-й недели гестации; доношенные дети от 0 до 27 дней; и всем детям от 28 дней до 2 лет, от 2 лет плюс 1 день до 11 лет и от 11 лет плюс 1 день до 18 лет.
Если продукт является дезинфицирующим средством, укажите, предназначен ли он для использования на поверхностях в больницах или пищевой промышленности, или для дезинфекции / стерилизации медицинских инструментов, или в бытовых условиях, или в домашних условиях, или для институциональных / промышленных или контактных линз
Секция № 66
Руководство
Если это лекарство, отпускаемое без рецепта (человеческое и / или ветеринарное), к которому применяется одна или несколько претензий из Списка А, заполните и отправьте Приложение 5.Для получения дополнительных указаний и информации обратитесь к «Проекту руководящего документа , Приложение А и раздел 3 к Закону о пищевых продуктах и лекарствах ».
Секция № 67
Руководство
Укажите предполагаемое показание / применение препарата, например: для лечения стенокардии и гипертонии, для лечения симптомов сенной лихорадки, для профилактики заражения вирусом кори.
Для нового лекарственного средства предлагаемое показание / использование должно быть кратким изложением показаний, описанных в монографии продукта.В этом разделе следует использовать ключевую научную терминологию.
Для дезинфицирующего препарата выберите один из двух вариантов: 1) Дезинфицирующее средство для твердых поверхностей; или 2) Средство для дезинфекции контактных линз. Предлагаемые показания как «дезинфицирующее / дезинфицирующее средство» или «средство для чистки унитаза» не допускаются.
Секция № 68
Руководство
Укажите предлагаемую дозировку лекарственного препарата, включая максимальную суточную дозу, например: 1 таблетка четыре раза в день.
Секция № 69
Руководство
Подтвердите, что черновики этикеток (внутренние и внешние) для использования в Канаде, включая вкладыш для упаковки, если он есть, включены в заявку. Черновик этикетки не включает Монографию продукта.
Для CTA и CTA-As, VIND и VIND-AM ярлыки не должны отправляться, если этого не требует соответствующий Директорат.
Секция № 70
Руководство
Заполните только в том случае, если предметом заявки на лекарство является SNDS, SANDS (все типы лекарств для человека), VSNDS, VSANDS (ветеринарные препараты) или биологический препарат DIN.Определите причину подачи предмета заявки, например новый способ введения или лекарственная форма, дополнительная сила. Отметьте все применимые варианты.
Секция № 71
Руководство
Заполните, только если предметом заявки является изменение, подлежащее уведомлению, на новый (лекарственный или ветеринарный) препарат. Ссылаясь на «Руководящий документ по внесению изменений после NOC» Министерства здравоохранения Канады, укажите все применимые изменения, к которым относится данное сообщение.
Секция 72-74
Руководство
Полные разделы 72-74 только для ветеринарных препаратов
Секция № 72
Руководство
Укажите виды и подтипы, для которых предназначен лекарственный препарат, например: домашняя птица (виды) — куры-несушки (подтип).
Секция № 73
Руководство
Укажите, предназначен ли препарат для использования у сельскохозяйственных животных.
Секция № 74
Руководство
Укажите предлагаемое время вывода для каждого вида, указанного в Разделе 72.
Секция № 75
Руководство
Напечатайте имя лица, уполномоченного производителем / спонсором, указанным в Разделе 11, подписать эту форму, то есть лицо, подписывающее форму, подтверждает, что информация, представленная в форме, соответствует пожеланиям производителя / спонсора.
Секция № 76-77
Руководство
Подпись уполномоченного подписывающего лица (76) и дата подписания формы (год / месяц / день) (77).
Секция № 78-80
Руководство
Название должности, занимаемой уполномоченным должностным лицом, подписывающим документы (78), и номера его / ее телефона и факса (79-80).
Секция № 81
Руководство
Название компании, к которой принадлежит уполномоченное лицо, подписывающее документы.Если подписывающее лицо является третьей стороной, принадлежащей компании, отличной от компании-производителя / спонсора, указанной в Разделе 11, разрешительное письмо, подписанное компанией-производителем / спонсором (раздел 11), должно быть подано вместе с Формой заявки на подачу лекарственного препарата (см. Приложение 2).
Раздел № Приложение 1
Руководство
Заполните Приложение 1 (или аналогичное разрешение) только для заявлений о клинических испытаниях и поправок. Форма должна быть заполнена и отправлена, если спонсор клинического исследования разрешает одной или нескольким третьим сторонам импортировать лекарства для клинических испытаний в Канаду. В списке должен быть указан каждый импортер, уполномоченный импортировать новое лекарство в Канаду для целей клинических испытаний, описанных в этой заявке. По мере выявления дополнительных импортеров в Министерство здравоохранения Канады следует направлять дополнительные копии Приложения 1. Если импортер не изменился при подаче поправки к заявке на клиническое исследование, Приложение 1 не нужно повторно подавать.
Для каждого протокола должен быть предоставлен отдельный HC / SC 3011 и соответствующее Приложение 1.
Раздел № Приложение 2
Руководство
Заполните Приложение 2 (или аналогичное разрешение) только в том случае, если сторона, подписывающая HC / SC 3011, является третьей стороной, действующей от имени компании-производителя / спонсора, указанной в разделе 11. Обратите внимание, что для каждого приложения требуется отдельное разрешение. .
Раздел № Приложение 3
Руководство
Заполните Приложение 3 — Информация о заявке на клиническое испытание только для внесения поправок в заявку на клиническое испытание и Заявку на клиническое испытание.Подписанное и датированное Приложение 3 необходимо присоединить к форме HC / SC 3011 при подаче клинического исследования или поправки (клинической или качественной) к ранее утвержденному клиническому исследованию.
Секция № 82
Руководство
Укажите номер протокола клинического исследования. Обратите внимание, что номер протокола должен оставаться неизменным на протяжении всего испытания. Допускается указывать версию или номер поправки протокола, представленного при подаче заявки; однако всегда должен указываться исходный номер протокола.
Секция № 83
Руководство
Укажите название протокола клинического исследования.
Секция № 84
Руководство
Для исследуемого продукта, участвующего в клиническом испытании, укажите, используется ли продукт, продаваемый в Канаде. Если используется продукт, продаваемый в Канаде, укажите идентификационный номер лекарства (DIN). Если используется продукт, продаваемый за границей, укажите страну (страны), из которой продукт был получен.Если исследуемый продукт нигде не продается, введите N / A.
Секция № 85
Руководство
Укажите, будет ли клиническое испытание включать педиатрическое население в возрасте 0–18 лет (женщины и / или мужчины) и / или взрослое население (женщины и / или мужчины).
Педиатрическая популяция : термин, определенный в Правилах по пищевым продуктам и лекарствам (C.08.004.1) следующим образом: недоношенные дети, родившиеся до 37-й недели гестации; доношенные дети от 0 до 27 дней; и всем детям от 28 дней до 2 лет, от 2 лет плюс 1 день до 11 лет и от 11 лет плюс 1 день до 18 лет.
Отметьте все применимые опции.
Секция № 86
Руководство
Укажите, какая фаза клинического исследования подана. Дополнительную информацию см. В Руководстве для спонсоров клинических испытаний — Заявки на участие в клинических испытаниях.
Секция № 87
Руководство
Если Совет по этике исследований отказался утвердить протокол клинического испытания и / или форму информированного согласия, подтвердите, что информация, указанная в «Руководстве для спонсоров клинических испытаний», включена в заявку.Если ни один Совет по этике исследований не отказался утвердить протокол и / или форму информированного согласия, отметьте «Неприменимо» для «неприменимо». Если еще не известно, отказал ли Совет по этике исследований, отметьте «В настоящее время неизвестно».
Секция № 88
Руководство
Заполненная форма информации о месте проведения клинических испытаний должна быть приложена к каждому предлагаемому участку клинических испытаний, известному на момент подачи заявки на проведение клинического испытания или внесения поправок. Не предоставляйте формы до тех пор, пока не будут заполнены все поля, включая разделы 37 и / или 45 Информационной формы места проведения клинических испытаний.
Для всей информации о клинических испытательных центрах, которая становится доступной после момента подачи заявки, заполненная форма с информацией о клинических испытательных центрах должна быть предоставлена в соответствующее Управление до начала испытания.
Секция № 89-90
Руководство
Напечатайте имя старшего врача или научного сотрудника в Канаде (89), а также его / ее номер телефона и адрес (90). Это научный или медицинский сотрудник, проживающий в Канаде, представляющий спонсора, который несет ответственность за предоставление свидетельства о CTA или CTA-A во время подачи заявки, как указано в Приложении 3.
Секция № 91-92
Руководство
Подпись старшего медицинского или научного сотрудника в Канаде (91) и дата подписания формы (год / месяц / день) (92).
Секция № 93-94
Руководство
Напечатайте имя старшего исполнительного директора спонсора (93) и его / ее номер телефона (94).
Для клинических исследований , инициированных учреждением / исследователем, соответствующий руководитель отдела может подписать контракт вместо старшего исполнительного директора.
Секция № 95-96
Руководство
Подпись старшего исполнительного директора спонсора (95) и дата подписания формы (год / месяц / день) (96).
Раздел № Приложение 4
Руководство
Если вы отметили «Нет» для всех вопросов, перечисленных в разделах 56, 57 и 58, тем самым указав, что не содержит ингредиентов животного и / или человеческого происхождения, то не заполняйте это приложение.
Пожалуйста, заполните отдельное Приложение 4 для для каждого отдельного ингредиента и / или материала , используемых на любом этапе производства лекарственного препарата, который был идентифицирован как полученный от животного и / или человеческого происхождения в части 2 — Информация о составе лекарственного препарата ‘Формы заявки на лекарственный препарат.
Для биологического продукта разрешается подавать информацию об источнике конкретного антигена человека / животного под одним брендом в качестве основного, а затем делать перекрестные ссылки на них в последующих представлениях для продуктов разных брендов, содержащих те же антигены.В этом случае спонсор должен указать информацию о перекрестных ссылках, указав название бренда, DIN и название антигена на отдельной странице вместо заполнения формы ткани человека / животного.
Нет необходимости повторно подавать Приложение 4 для последующей подачи для того же продукта, если нет изменений в медицинской, немедицинской информации и ее источнике.
Целью запроса дополнительной информации об ингредиентах животного происхождения является сбор соответствующих данных о составе лекарственных препаратов и использование этой информации в любое время в течение жизненного цикла продукта, если это необходимо.
Раздел № 97
Руководство
Перечислите лекарственные и немедицинские ингредиенты и материалы животного и / или человеческого происхождения, используемые на любой стадии производства лекарственного препарата, по их собственному или общепринятому названию.
Заполните отдельное Приложение 4 для каждого отдельного ингредиента лекарственного препарата и / или материала, используемого на любой стадии производства лекарственного препарата, который был идентифицирован как полученный от животных и / или людей.
Раздел № 98
Руководство
Укажите, используется ли ингредиент / материал животного и / или человеческого происхождения в качестве лекарственного (активного) ингредиента, немедицинского ингредиента или материала, используемого на любой стадии производства лекарственного препарата.
Раздел № 99
Руководство
Укажите, получен ли ингредиент от человека и / или животного (-ей). Для животных отметьте соответствующий квадратик и укажите вид в указанной категории.Например, если животное является цервидным, укажите, является ли это лосем, оленем, лосем и т. Д.
Контролируемая популяция: Укажите, получен ли ингредиент от животного (ов), принадлежащего к исключительной популяции, выращенного специально с целью борьбы с болезнью, или выращенного специально для использования в фармацевтической промышленности (например, соответствующая сертификация или признание стандартов национальный, международный или сторонний).
Животное, полученное с помощью биотехнологии: Укажите, получен ли ингредиент от животного (ов), полученного с помощью биотехнологии.
Правила о здоровье животных в соответствии с Законом о здоровье животных определяют биотехнологию как «применение науки и техники для прямого или косвенного использования живых организмов или частей или продуктов живых организмов в их естественных или измененных формах». Термин «животные, полученные с помощью биотехнологии» является расширением определения биотехнологии. Это относится к животным, созданным с помощью биотехнологических методов. Для получения дополнительной информации, пожалуйста, обратитесь к «Системе анализа рисков для здоровья животных для животных, полученных с помощью биотехнологии» Канадского агентства по надзору за пищевыми продуктами.
Раздел № 100
Руководство
Укажите ткани и жидкости, используемые в качестве источника ингредиентов.
Раздел № 101
Руководство
Укажите возраст животного (в месяцах) на момент получения ткани / жидкости / макромолекул. Допустимо указать возраст (в месяцах).
Раздел № 102
Руководство
Укажите все страны, в которых животное родилось и проживало.
Всемирная организация здравоохранения животных (МЭБ) определяет страны в соответствии со схемой категоризации риска ГЭ КРС. Лекарственные препараты, содержащие ткани животных, поступающие из юрисдикции с «контролируемым риском» или «неопределенным риском», как это определено МЭБ, требуют химической и производственной оценки со стороны Министерства здравоохранения Канады. Пожалуйста, посетите веб-сайт МЭБ для получения дополнительной информации о классификации рисков BSE, доступной по адресу: www.oie.int
Раздел Приложение 5
Руководство
Обратите внимание, что эта форма должна быть заполнена ТОЛЬКО для продуктов, отпускаемых без рецепта, за исключением натуральных продуктов для здоровья, которые связаны с заявлениями из Списка А.Другими словами, если в разделе 66 формы помечено «ДА», заполните и отправьте Приложение 5. Для получения дополнительных указаний и информации относительно Приложения А, пожалуйста, обратитесь к Приложению А проекта Руководящего документа и Разделу 3 Пищевых продуктов и лекарственных средств. Действовать’.
Раздел № 103
Руководство
Укажите производителя / спонсора, как указано в разделе 11 выше.
Раздел № 104
Руководство
Укажите название продукта, как указано в разделе 8 выше.
Раздел № 105
Руководство
Определите идентификационный номер лекарства (DIN), если он уже был выдан.
Раздел № 106
Руководство
Отметьте все заболевания / расстройства, относящиеся к заявленным претензиям.
Раздел № 107
Руководство
Перечислите претензии / указания Приложения A, связанные с продуктом, перечисленным в разделе 104.
Сноски
- Сноска 1
Подача идентификационного номера лекарственного средства (DIN) для фармацевтических, биологических и дезинфицирующих препаратов, которые не подпадают под действие Раздела 8, Часть C Правил по пищевым продуктам и лекарствам (то есть, которые не считаются новыми лекарствами).
Вернуться к сноске 1 Реферер
- Сноска 2
Пост-авторизационное изменение Отдела 1 / Ветеринарное Пост-авторизационное изменение Отдела 1 (PDC / VPDC) — это процесс уведомления об изменениях в ранее санкционированных лекарствах Подразделения 1 (кроме тех, для которых требуется измененный идентификационный номер лекарственного средства / идентификационный номер ветеринарного лекарственного средства (DIN / VDIN) приложение)
Вернуться к сноске 2 Реферер
- Сноска 3
Подача идентификационного номера ветеринарного лекарственного средства (DIN) для фармацевтических и дезинфицирующих препаратов, которые не подпадают под действие Раздела 8, Часть C Правил по пищевым продуктам и лекарствам (то есть, которые не считаются новыми лекарствами)
Вернуться к сноске 3 Реферер
- Сноска 4
Для заявок, поданных в соответствии с Временным приказом о ввозе, продаже и рекламе лекарств для использования в связи с COVID-19 .Для получения дополнительной информации о получении разрешения в соответствии с Временным приказом, пожалуйста, обратитесь к руководящему документу: Информация и требования к заявкам на лекарства, разрешенные в соответствии с Временным приказом (https://www.canada.ca/en/health-canada/services/drugs -health-products / covid19-индустрия / лекарства-вакцины-лечение / временный-заказ-импорт-продажа-реклама-лекарства / guide.html).
Вернуться к сноске 4 Реферер
PMA Application Contents | FDA
НОВИНКА:
Сертификат соответствия клиническим испытаниям.gov Data Bank, FDA-3674 *
* Начиная с 26 декабря 2007 г., все заявки PMA должны включать заполненную копию формы FDA-3674. Дополнительную информацию см. В форме FDA-3674, банк данных ClinicalTrials.gov.
Обязательные элементы (§814.20)
Предварительно распечатанная форма для заявления PMA отсутствует. Если пропуск не оправдан заявителем [§814.20 (d)], PMA должен включать все следующее:
- Имя и адрес заявителя.
- Оглавление, в котором указывается том и номер страницы для каждого элемента, указанного в таблице.
- PMA должен включать отдельные разделы, посвященные доклиническим лабораторным исследованиям и клиническим исследованиям с участием людей.
- Коммерческая тайна или конфиденциальная коммерческая или финансовая информация должна быть включена во все копии PMA. Заявитель должен указать хотя бы в одной копии любую информацию, которую он считает коммерческой тайной или конфиденциальной коммерческой или финансовой информацией.
- Сводный раздел, достаточно подробный, чтобы дать общее представление о данных и информации в приложении.Совет: сводный раздел должен содержать краткое изложение основных моментов, найденных в других частях PMA, и должен занимать примерно 10-15 страниц.
Сводный раздел должен содержать следующую информацию:
Показания к применению. Дайте общее описание заболевания или состояния, которое устройство будет диагностировать, лечить, предотвратить, вылечить или смягчить, и включите описание группы пациентов, для которой предназначено устройство.
Описание прибора .Объясните, как работает устройство, основные научные концепции, лежащие в основе устройства, а также важные физические и рабочие характеристики устройства. Краткое описание производственного процесса должно быть включено, если оно значительно улучшит понимание читателем устройства. Необходимо указать общее название устройства, а также любое собственное или торговое наименование.
Альтернативные методы и процедуры . Опишите любые альтернативные методы или процедуры для диагностики, лечения, предотвращения, лечения или смягчения заболевания или состояния, для которого предназначено устройство.
Совет: включите такое заявление, как «другие коммерчески доступные устройства», если доступны аналогичные продукты класса III. Не включайте никакие лечебные практики или процедуры, которые считаются исследовательскими.
История маркетинга . Кратко опишите историю продаж устройства, известного заявителю, за рубежом и в США, если таковая имеется. Как минимум, включите список всех стран, в которых продается устройство, и список всех стран, в которых устройство было снято с продажи по любой причине, связанной с безопасностью или эффективностью устройства.
Совет: было бы целесообразно включить даты внедрения в каждую страну, информацию о количестве продуктов, распространяемых в каждой стране, краткое описание любого механизма отчетности об опыте, краткое изложение любого сообщенного неблагоприятного опыта и информацию о любых изъятиях для любая причина, связанная с безопасностью или эффективностью. Не следует включать снятие средств из-за плохих продаж или нежелания врача. История маркетинга в США может появиться, если устройство продается под 510 (k) для другого предполагаемого использования.Описание должно включать в себя историю продажи устройства заявителем и, если известно, историю продажи устройства любым другим лицом.
Резюме исследований . Этот раздел должен содержать краткое изложение результатов технических данных (доклинических и клинических исследований) в соответствии с §814.20 (b) (6) и краткое изложение любых других данных, информации или отчета, описанных в PMA в соответствии с §814.20 (b) ( 8) (ii). Резюме должно включать описание цели каждого исследования, описание экспериментального плана исследования (или проверенной гипотезы), краткое обсуждение того, как данные были собраны и проанализированы, а также краткое описание результатов и выводов. будь то положительный, отрицательный или неубедительный.
Резюме должно включать краткое изложение доклинических лабораторных исследований, представленных в заявке, и сводку клинических исследований с участием людей. Резюме клинических исследований должно включать обсуждение критериев выбора и исключения субъектов, демографические характеристики исследуемой популяции, период исследования, данные по безопасности и эффективности, побочные реакции и осложнения, прекращение лечения пациента, отказы и замены устройств, таблицы данных из всех отчетов отдельных субъектов. формы и копии таких форм для каждого субъекта, который умер во время клинического исследования или который не завершил его, результаты статистического анализа клинических исследований, противопоказания и меры предосторожности при использовании устройства, а также другую информацию из клинических исследований, как подходящее.Любое расследование, проводимое в среде IDE, должно быть идентифицировано.
Выводы по результатам исследований . Обсудите, как данные и информация в приложении представляют собой достоверные научные доказательства в соответствии с 21 CFR 860.7, Определение безопасности и эффективности, и предоставьте разумную уверенность в том, что устройство безопасно и эффективно для предполагаемого использования. В заключительном обсуждении должны быть представлены соображения относительно преимуществ и рисков, связанных с устройством, включая обсуждение любых неблагоприятных воздействий устройства на здоровье, а также любые предлагаемые дополнительные исследования или наблюдения, которые заявитель намеревается провести после утверждения PMA.
Совет. В сводном разделе заявителя следует объективно увязывать медицинские претензии к устройству с проверенными гипотезами и выводами, сделанными на основе результатов всех исследований и исследований. Следует избегать предвзятого представления данных исследования и включения рекламных заявлений. При подготовке итогового раздела кандидат должен уметь обнаруживать и исправлять любые несоответствия в отчетности, неполные отчеты и недостатки дизайна исследования, которые могут быть обнаружены в ходе углубленного научного обзора.Правильно составленный сводный раздел заявителя может служить основой для сводных данных FDA по безопасности и эффективности и облегчит процесс рассмотрения FDA и группой экспертов. Полный и подробный отчет о клинических исследованиях и подтверждающих данных необходим для выполнения юридических требований, установленных Законом о FD&C. Для более подробного обсуждения того, как разработать, задокументировать и представить клиническое исследование для демонстрации безопасности и эффективности, см. «Статистическое руководство по клиническим испытаниям недиагностических медицинских устройств».
- Полное описание:
- прибор, в том числе графические изображения;
- каждый из функциональных компонентов или ингредиентов устройства, если устройство состоит из более чем одного физического компонента или ингредиента;
- свойства устройства, относящиеся к диагностике, лечению, профилактике, лечению или смягчению последствий заболевания или состояния;
- принципы работы устройства; и
- методы, средства и средства контроля, используемые при производстве, переработке, упаковке, хранении и, где это необходимо, установке устройства, достаточно подробно, чтобы лицо, в целом знакомое с современной надлежащей производственной практикой, могло сделать обоснованное суждение о контроле качества. использованный при изготовлении устройства.Дополнительное руководство по производственной информации, которую необходимо включить в заявку PMA, можно найти в «Информации о системе качества для некоторых обзоров предпродажной подготовки».
Совет: Если полная информация о производстве недоступна на момент подачи PMA, ее временное упущение может быть оправдано, как это предусмотрено в 21 CFR 814.20 (d). См. Пункт 31 в преамбуле к регламенту PMA для получения дополнительной информации.
Ссылка на любой стандарт производительности или добровольный стандарт.
Стандарт эффективности относится к тем, которые были обнародованы в соответствии с частью 514 Закона о FD&C или Закона о радиационном контроле за здоровьем и безопасностью 1968 года (RCHSA), действующими или предложенными на момент подачи PMA. В настоящее время стандарт производительности для проводов отведений электродов и кабелей пациента согласно 21 CFR 898 является единственным стандартом производительности, установленным для медицинских устройств. Стандарты производительности, установленные в рамках RCHSA, можно найти в 21 CFR, части с 1000 по 1050. Доступ к стандартам производительности RCHSA доступен в Интернете.
Добровольный стандарт относится к стандарту, который конкретно применим к любому аспекту безопасности или эффективности устройства и разработан в соответствии с политическим заявлением FDA о разработке стандартов, опубликованным в Федеральном реестре от 23 октября 1985 г. (50 FR 43081 ). FDA признало множество добровольных стандартов. Руководство по признанию и использованию согласованных стандартов, а также базу данных согласованных стандартов, признанных FDA, можно найти в Интернете.
Кандидат должен предоставить адекватную информацию, чтобы продемонстрировать, как устройство соответствует или оправдать любое отклонение от любого из обязательных стандартов производительности, указанных выше, и объяснить любое отклонение от добровольного стандарта.
Технические разделы, содержащие данные и информацию, достаточно подробные, чтобы позволить FDA определить, одобрить или отклонить заявку.
Эти разделы и их содержание следующие:
Результаты доклинических лабораторных исследований — Этот раздел должен содержать результаты доклинических лабораторных исследований с устройством, включая микробиологические, токсикологические, иммунологические, биосовместимости, стресс, износ, срок годности и другие лабораторные тесты или тесты на животных, в зависимости от ситуации.Информация о доклинических лабораторных исследованиях должна включать заявление о том, что каждое исследование проводилось в соответствии с 21 CFR 58, Надлежащая лабораторная практика для доклинических лабораторных исследований. Если исследование не проводилось в соответствии с этим правилом, кратко опишите причину несоблюдения.
Результаты клинических исследований с участием людей — Этот раздел должен включать клинические протоколы, количество исследователей и субъектов на одного исследователя, обсуждение критериев выбора и исключения субъектов, демографические данные исследуемой популяции, период исследования, данные по безопасности и эффективности, побочные реакции и осложнения, прекращение лечения пациента, жалобы пациентов, отказы и замены устройств, таблицы данных из всех индивидуальных форм отчетности субъектов и копии таких форм для каждого субъекта, который умер во время клинического исследования или который не завершил исследование, результаты статистического анализа клинические исследования, противопоказания и меры предосторожности при использовании устройства, а также другая информация, полученная в ходе клинических исследований, в зависимости от обстоятельств.Анализ и обсуждение должны касаться воздействия, если таковое имеется, на меры безопасности и эффективности. Должна быть включена дополнительная информация, такая как анализ и обсуждение любых потенциальных предубеждений, связанных с полом, расой / этнической принадлежностью и т. Д. Любые различия в безопасности и / или эффективности должны быть описаны на этикетке.
Приложение PMA или PMA, если применимо, требуется согласно § 814.20 (b) (6) (ii), чтобы включать копии индивидуальных форм отчетов для каждого субъекта, который умер во время клинического исследования или не завершил его.Перед подачей PMA кандидат должен проконсультироваться с отделом проверки OPEQ, чтобы определить, какая информация должна быть включена в эти формы отчетов, и будут ли эти формы отчетов потребоваться для других субъектов, включенных в исследование (например, субъектов, испытывающих указанные побочные эффекты или осложнения. ).
Информация о клинических исследованиях с участием людей в качестве субъектов должна включать следующие утверждения в отношении каждого исследования:
- , что оно было проведено в соответствии с правилами Совета по институциональной проверке в соответствии с 21 CFR 56 или не подпадало под правила в соответствии с 21 CFR 56.104 или 21 CFR 56.105,
- , что оно было проведено в соответствии с положениями об информированном согласии в соответствии с 21 CFR 50 и
- , что оно было проведено в соответствии с положениями об исключениях для исследуемых устройств согласно 21 CFR 812, касающимся спонсоров клинических исследований и клинических исследователей.
Если исследование не проводилось в соответствии с этими правилами, включите краткое изложение причины несоблюдения.
- Для PMA, основанного исключительно на данных одного исследователя, обоснование, показывающее, почему данных и другой информации от одного исследователя достаточно для демонстрации безопасности и эффективности устройства и обеспечения воспроизводимости результатов испытаний.
- Библиография всех опубликованных отчетов, еще не представленных в соответствии с § 814.20 (b) (6), неблагоприятных или поддерживающих, которые известны или должны быть разумно известны заявителю и которые касаются безопасности или эффективности устройства. Кандидатам следует рассмотреть возможность предоставления копий всех ключевых статей, краткого изложения основных характеристик статьи и краткого обсуждения того, как статья связана с оценкой безопасности и эффективности их устройства.
Идентификация, обсуждение и анализ любых других данных, информации или отчета, относящихся к оценке безопасности и эффективности устройства, которые известны или должны быть известны заявителю из любого источника, иностранного или внутреннего.Сюда входит информация о расследованиях, отличных от предложенных в заявке, и об опыте коммерческого маркетинга.
- Один или несколько образцов устройства и его компонентов по запросу FDA. Если представить запрошенный образец устройства нецелесообразно, заявитель должен указать место, в котором FDA может проверить и протестировать одно или несколько устройств.
- Копии всей предлагаемой маркировки на устройство. Такая маркировка может включать, например, инструкции по установке и любую информацию, литературу или рекламу, которые составляют маркировку в соответствии с частью 201 (m) Закона о FD&C.Примечание. Любая реклама, разработанная заявителем, не являющаяся маркировкой, не подлежит представлению и рассмотрению до утверждения PMA.
- 21 CFR 814.20 (b) (11) гласит, что экологическая оценка в соответствии с 21 CFR 25 должна быть включена в заявку PMA. Обратите внимание, что PMA обычно не требуют экологической оценки (EA) или заявлений о воздействии на окружающую среду (EIS), если устройство относится к тому же типу и для того же использования, что и ранее утвержденное устройство [§25.34 (d)]. Пожалуйста, обратитесь к разделу «Особые соображения» PMA для получения дополнительной информации.
- Финансовое свидетельство или заявление о раскрытии информации или и то, и другое в соответствии с требованиями 21 CFR 54.
- Другая информация, которую может запросить FDA. При необходимости FDA получит согласие соответствующего консультативного комитета FDA перед запросом дополнительной информации.
Прочая информация . Соответствующая информация, уже содержащаяся в файлах FDA и специально упомянутая заявителем, может быть включена в PMA посредством ссылки.Информация в главном файле (см. «Основные файлы») или другая информация, представленная в FDA лицом, не являющимся заявителем, не будет считаться частью PMA, если такая ссылка не разрешена в письменной форме лицом, предоставившим информацию, или основной файл.
Упущения . Если заявитель считает, что определенная информация, необходимая в соответствии с §814.20 (b), неприменима к устройству, и пропускает такую информацию в своем PMA, заявитель должен предоставить заявление, в котором указывается пропущенная информация и оправдывается упущение.Заявление должно быть представлено в виде отдельного раздела в PMA и обозначено в оглавлении. Если FDA не согласится с обоснованием упущения, FDA уведомит заявителя.
Обновления . Кандидат должен периодически обновлять свою находящуюся на рассмотрении заявку любой новой информацией о безопасности и эффективности, полученной об устройстве из текущих или завершенных исследований, которые могут повлиять на оценку безопасности и эффективности устройства или которые могут повлиять на формулировку противопоказаний, предупреждений, мер предосторожности, и побочные реакции в проекте маркировки.Обновленный отчет должен соответствовать положениям протокола о представлении данных. Заявитель должен представить три копии любого обновленного отчета и указать в отчете номер PMA, присвоенный FDA. Эти обновления считаются поправками к ожидаемому PMA. Срок рассмотрения PMA будет , а не , будет продлен из-за представления отчета об обновлении, если обновление не является серьезной поправкой [§814.37 (c) (1)]. Заявитель должен представить эти отчеты через три месяца после даты подачи, после получения разрешительного письма, а также в любое другое время по запросу FDA.Примечание: это периодическое обновление ограничено исследованиями, спонсируемыми заявителем или к которым у заявителя есть разумный доступ.
Красящая добавка . Красящая добавка, используемая в устройстве или на нем, подпадает под действие Части 721 Закона FD&C и должна быть зарегистрирована для такого использования FDA. Если красящая добавка ранее не была включена в список FDA для такого использования, заявитель может запросить FDA включить красящую добавку в список, подав петицию о красящей добавке согласно 21 CFR 71 в Центр безопасности пищевых продуктов и прикладного питания (CFSAN).В качестве альтернативы запрос может быть отправлен в CDRH как часть PMA. Если запрос подан в PMA, должны быть включены три копии информации о добавлении цвета в петицию, каждая из которых связана в одном или нескольких пронумерованных томах разумного размера. PMA для устройства, содержащего красящую добавку, подпадающую под действие Части 721 Закона FD&C, не будет утвержден до тех пор, пока красящая добавка не будет включена в список FDA для использования в устройстве или на нем. См. «Добавки красителей для медицинских устройств» для получения дополнительной информации.
Обложка предмаркетных заявок
Заполнение этого предпродажного листа покрытия (форма FDA 3514) является добровольным и не повлияет на какое-либо решение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) относительно вашей заявки, но поможет Центру FDA по устройствам и радиологической безопасности обработать вашу заявку более эффективно, разместив административную элементы данных в согласованном формате для целей ввода данных. Титульный лист был разработан, чтобы уменьшить количество административных недостатков, характерных для многих представлений.
Предоставленная информация должна относиться только к одной сопроводительной заявке; пожалуйста, не присылайте титульные листы для любых предыдущих представлений. При отправке поправки или дополнения укажите номер документа и тип представления, а затем заполните только ту информацию, которая изменилась с момента вашего последнего титульного листа, относящегося к тому же представлению. Титульный лист следует использовать только для представленных материалов, на которые есть ссылки в титульном листе.
Сопроводительные письма
Сопроводительное письмо заявителя должно точно указывать тип представления PMA, т.е.е., исходный PMA, дополнение PMA, поправка PMA к ожидающему PMA или PMA дополнению, периодический отчет и т. д. и включает информацию, необходимую для целей отслеживания FDA. Чтобы ускорить его обработку, были подготовлены следующие предложения и форматы.
Общие предложения
- Используйте бланк заявителя или его уполномоченного представителя. Укажите действующий адрес электронной почты, поскольку все письма от FDA будут отправляться заявителю по электронной почте.
- Укажите сопроводительное письмо, как указано в разделе «Оригинал сопроводительного письма PMA» ниже. Чтобы свести к минимуму неправильную маршрутизацию, не включайте в адрес имя сотрудника FDA.
- Если подано кем-либо, кроме заявителя (например, юристом или консультантом), необходимо указать личность заявителя.
- Для оригинального PMA укажите показание для использования, для которого требуется одобрение FDA.
- Если применимо, включите ссылочные номера для любого предварительного уведомления, Q-Sub, модульного PMA, исключения для исследуемого устройства, петиции о реклассификации или петиции о добавлении красителей, представленных заявителем.
- Укажите, включает ли представление экологическую оценку.
- Поставьте дату и подпишите сопроводительное письмо и приложите копию к первому тому каждого экземпляра представления PMA.
Предлагаемые форматы
Полный формат сопроводительного письма для оригинального PMA приведен ниже. Для других типов представлений PMA предоставляется только тематический раздел и вступительное предложение (я). В некоторых случаях включены альтернативные вступительные заявления для решения конкретных ситуаций.
Оригинальное сопроводительное письмо PMA
[Дата]
Центр управления документами — WO66-G609
Центр устройств и радиологического здоровья
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов
10903 New Hampshire Avenue
Silver Spring, MD 20993-0002
ТЕМА: Оригинальный PMA для [торговое наименование устройства и номер модели, если применимо]
Для тех, кого это может касаться:
[имя заявителя] представляет эту первоначальную заявку на предварительное одобрение для [торговое наименование устройства], [общее название устройства] , предназначенного для использования в [указание для использования] .
Клинические исследования вышеуказанного устройства были начаты [дата], и [были / не были] проведены в рамках утвержденного исключения для исследуемого устройства [укажите номер IDE, если устройство значительного риска] . [Если возможно, укажите ссылочный номер FDA для любого предпродажного уведомления, петиции о реклассификации или петиции о добавке красителей, представленных для этого устройства].
[Включите абзац с названием и адресом каждого предприятия, участвующего в производстве устройства, и укажите, подготовлено ли предприятие к инспекции FDA.Если не подготовлен, укажите предполагаемую дату, когда объект будет готов к проверке. Если запрашивается отказ от информации QS, укажите предполагаемую дату, когда информация будет предоставлена.]
Если другой документ включен посредством ссылки, например, мастер-файл, пожалуйста, включите оригинал авторизационного письма в качестве приложения к этому сопроводительному письму.
Существование этого PMA, а также данные и другая информация, которые он содержит, являются конфиденциальными, и настоящим заявляется защита такой конфиденциальной информации согласно 18 USC 1905, 21 USC 331 (j), 5 USC 552 и другим применимым законам.[ Совет : требования о конфиденциальности не могут быть предъявлены, если заявитель не выполнил применимые требования.
Если есть вопросы относительно этой заявки, с [имя] можно связаться по телефону [укажите номер телефона, включая код города] .
С уважением,
[подпись]
[ФИО и должность представителя заявителя]
Поправка к оригинальному PMA
ТЕМА: Поправка к [исходный ссылочный номер PMA или дополнения PMA] для [торговое наименование устройства]
Дополнительная информация без запроса
[название поставщика ] представляет эту поправку к своему [предварительная заявка на одобрение] [исходный ссылочный номер PMA] для [торговое наименование устройства] , чтобы предоставить [указать дополнительную предоставляемую информацию] .
Предлагаемый формат и адрес
PMA должен быть представлен в электронном формате (eCopy) с подписанным печатным сопроводительным письмом. PMA должен быть подписан заявителем или уполномоченным представителем США. Если заявитель не проживает или не имеет коммерческого предприятия в США, PMA должен быть подписан уполномоченным представителем, который это делает. Заявитель также должен указать имя и адрес представителя.
Пакет для подачи заявки на медицинское оборудование следует отправить в CDRH или в Центр контроля документации CBER (DCC).Текущий почтовый адрес DCC CDRH и ссылка на почтовый адрес DCC CBER приведены на веб-странице eCopy Program for Medical Device Submissions.
Мы рекомендуем вам отправить PMA в FDA способом, который обеспечит подписанную квитанцию о доставке, например, заказным письмом с уведомлением о вручении или коммерческой службой доставки. Вы должны получить подтверждение получения от FDA, в котором указан присвоенный номер PMA. На веб-странице процесса проверки PMA описан процесс проверки после получения заявки в FDA.
После получения PMA FDA мы НЕ возвращаем его. Вы должны сохранить копию PMA для своих записей.
Для облегчения работы FDA с приложениями PMA предлагаются следующие дополнительные рекомендации:
- Четко и на видном месте идентифицируйте подачу как оригинальную заявку PMA или, для дополнительных подач к заявке PMA, четко укажите номер документа, присвоенный FDA (например, P960000) и тип подачи (например, P960000).g., поправка, дополнение или отчет) или ответ (например, ответ на письмо FDA от _______).
- Последовательно пронумеруйте страницы, предоставив подробное оглавление.
- Не объединяйте PMA, IDE и 510 (k) вместе. Это должны быть отдельные материалы.
- Только заявитель PMA, зарегистрированный в FDA, может изменять, дополнять или подавать отчеты в свой PMA, если PMA не включает оригинал, а не копию соответствующего доверенности от заявителя, разрешающей другому лицу подавать информацию от имени заявителя. .Если информация о названии компании заявителя или информация о назначенном заявителе изменится, сообщите об этом FDA в форме поправки к PMA или дополнению PMA.
Сводка данных по безопасности и эффективности (§814.44)
ОбзорЗакон о пищевых продуктах, лекарствах и косметических средствах (Закон FD&C) требует, чтобы FDA подготовило подробное резюме данных о безопасности и эффективности (SSED), на котором основывается решение об одобрении или отказе.
ОрганКраткое изложение данных по безопасности и эффективности (SSED) предусмотрено 520 (h) (1) (A) Закона о FD&C. Это необходимо заполнить для всех решений об утверждении и отказе в отношении исходных PMA и дополнений к PMA для панельных треков.
НазначениеSSED — это документ FDA, в котором кратко излагается основное содержание PMA, такое как описание устройства, доклинические данные и клинические доказательства, а также анализ FDA научных данных, послуживших основанием для решения FDA относительно разумной гарантии. безопасности и эффективности устройства.
Шаблон SSED описывает содержимое SSED, которое следует за разделом и содержимым, описанным в 21 CFR 814.20 (b). Шаблон обновляется по мере необходимости, чтобы отразить текущую политику.
Где находитсяSSED можно найти с пакетом утверждения утвержденного PMA, который находится в базе данных PMA: http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfPMA/pma.cfm
FDA разрабатывает общедоступный SSED с использованием этого шаблона.Заявитель PMA не несет ответственности за заполнение или отправку этого документа.
Контрольный список проверки PMA
Контрольный список, упомянутый ниже, используется рецензентами PMA для определения полноты PMA и является частью памятки Синей книги, Процедуры отказа PMA в подаче документов 5/2/94 (P94-1). Кандидаты в PMA могут также пожелать использовать контрольный список, чтобы убедиться в полноте заявки.
Проверка подачи заявки на одобрение перед выпуском на рынок
Список литературы
Ссылки на содержимое приложения PMA
.




 Вы можете скачать пример положения о выдаче подотчетных денежных средств.
Вы можете скачать пример положения о выдаче подотчетных денежных средств. 26 Положения, утв. Постановлением Правительства РФ от 13.10.2008 № 749).
26 Положения, утв. Постановлением Правительства РФ от 13.10.2008 № 749).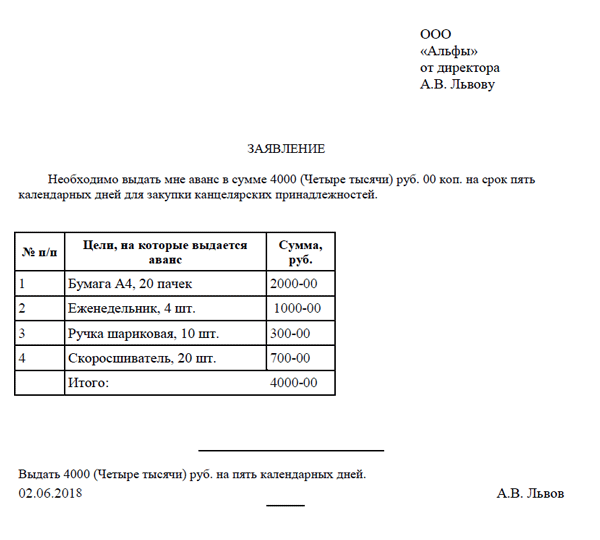 Так можно поступать с 19 августа 2017 года. Однако это не означает, что оформлять авансовые отчеты по израсходованным сумма работникам больше не нужно. Даже после 19 августа 2017 года (например, в 2020 году) о потраченных деньгах работник должен передать в бухгалтерию отчетные документы.
Так можно поступать с 19 августа 2017 года. Однако это не означает, что оформлять авансовые отчеты по израсходованным сумма работникам больше не нужно. Даже после 19 августа 2017 года (например, в 2020 году) о потраченных деньгах работник должен передать в бухгалтерию отчетные документы. gov, поступят в систему eRA NIH и пройдут серию проверок, чтобы убедиться, что вся необходимая информация включена и в соответствующем формате. Как только ваша заявка будет успешно подтверждена системой NIH eRA, она будет отправлена в SAMHSA как принимающее учреждение для дальнейшего рассмотрения.
gov, поступят в систему eRA NIH и пройдут серию проверок, чтобы убедиться, что вся необходимая информация включена и в соответствующем формате. Как только ваша заявка будет успешно подтверждена системой NIH eRA, она будет отправлена в SAMHSA как принимающее учреждение для дальнейшего рассмотрения. Дата и время подачи записываются. Эти сведения можно просмотреть на странице «Просмотр истории состояний». Кроме того, ASSIST отправляет уведомление соответствующим сторонам, чтобы проинформировать их о том, что заявка подана. Это включает SO и PD / PI.
Дата и время подачи записываются. Эти сведения можно просмотреть на странице «Просмотр истории состояний». Кроме того, ASSIST отправляет уведомление соответствующим сторонам, чтобы проинформировать их о том, что заявка подана. Это включает SO и PD / PI. gov (AOR).
gov (AOR).